Inleiding tot carbonylgroep
in de organische chemie is carbonylgroep een functionele groep waarbij koolstof – en zuurstofatoom met een dubbele binding verbonden zijn. De verbindingen bevatten carbonylgroep staan bekend als carbonylverbindingen. Carbonylgroep verwijst naar een koolmonoxide kan ook bevestigd aan een anorganisch atoom als een ligand dat wordt genoemd metaal carbonyl, bijvoorbeeld nikkel carbonyl.,
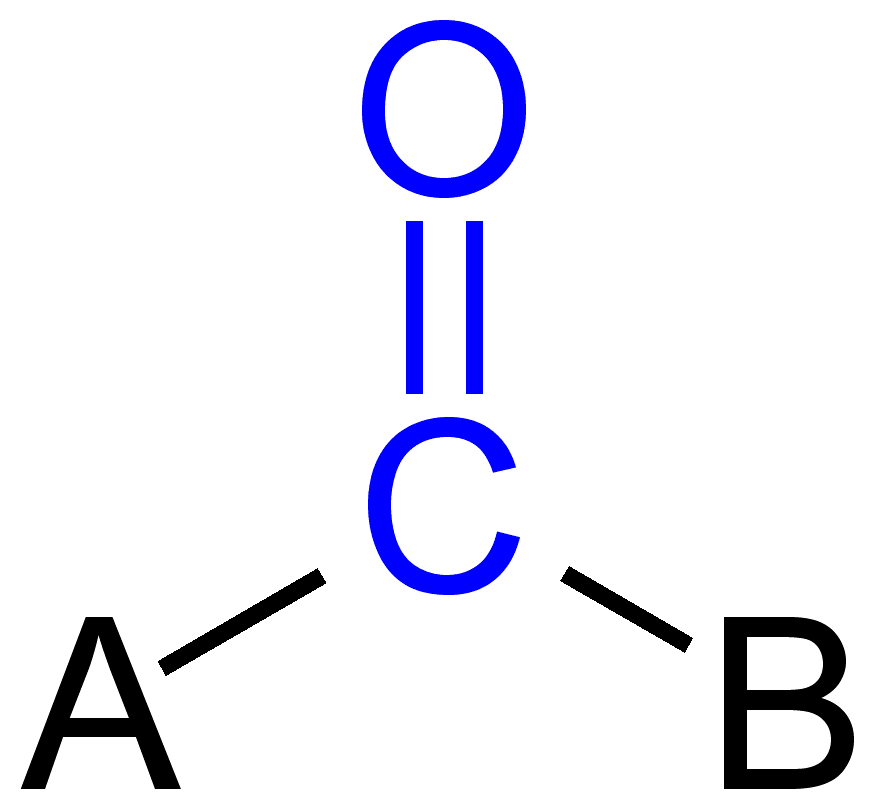
sommige carbonylgroepen
dubbele binding in carbonylgroep
het koolstof-en zuurstofatoom in carbonylgroep zijn normaal gesproken gehybridiseerd door sp2 en dus plannar. Door de aanwezigheid van zuurstof als elektronegatief atoom is de dubbele binding in carbonylgroep anders dan de dubbele binding in alkenen in termen van reactiviteit. Vanwege meer elektronegativiteit en aanwezigheid van twee eenzame paar elektronen, wordt zuurstof gedeeltelijk negatieve lading terwijl carbonylkoolstof gedeeltelijk positieve lading produceert en dus polariteit wordt waargenomen.,
Carbonylresonantiestructuur
vanwege de aanwezigheid van zuurstof als elektronegatief atoom vertoont de carbonylgroep resonantiestructuur. De resonantiestructuur van de carbonylgroep beïnvloedt de reactiviteit van de verbinding. Het meer elektronegatieve zuurstofatoom trekt elektron weg uit koolstofcentrum maakt de carbonylkoolstof gedeeltelijk elektropositief en de zuurstof gedeeltelijk elektronegatief. Zo genereert polariteit binnen de carbonylverbinding.
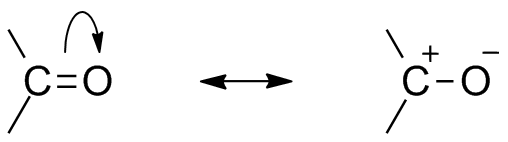
deze elektropositieve carbonylkoolstof of elektrofiel kan nu worden aangevallen door een nucleofiel.,
reactiviteit
Carbonylalkylering
alkylering van de carbonylgroep door nucleofiele additie met behulp van Grignardreagens worden als volgt weergegeven:

fysische eigenschappen van carbonylverbindingen
- het kookpunt van aldehyden en ketonen is hoger dan het kookpunt ethers en alkanen met een vergelijkbare molecuulmassa.ook hier ligt het kookpunt van aldehyden en ketonen lager dan de overeenkomstige alcoholen.,
- veel hogere aldehyden hebben een aangename geur en worden gebruikt in parfums of als kunstmatige smaakstof, terwijl het onderste lid van hun homologe reeks een penetrante geur heeft.
- hogere ketonen hebben een zwakke geur en lagere hebben een aangename geur, zoals aceton.
- kleine aldehyden en ketonen zijn oplosbaar in water, maar naarmate de lengte van de keten toeneemt, neemt de oplosbaarheid af.
- De Van der Waals-dispersiekrachten worden sterker naarmate de moleculen langer worden.,
H-binding in carbonylgroep
door de vorming van H-binding tussen de carbonylzuurstof en de waterstof van het watermolecuul, zijn de lagere carbonylverbindingen oplosbaar in water. Maar als de keten toeneemt, komt het op weg om waterstofbinding te vormen en neemt de oplosbaarheid af.
van der Waals dipool-dipool attractie
vanwege de polariteit in de carbonylgroep en de aanwezigheid van dispersiekrachten zal er een attractie zijn tussen twee nabijgelegen moleculen. Hierdoor gaat het kookpunt van carbonylverbindingen hoger dan de overeenkomstige alkanen., Merk In de volgende tabel op dat het kookpunt van carbonylverbindingen hoger is dan de overeenkomstige alkanen en lager dan de alcoholen.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Gewoonlijk vertoont de absorptie van infra licht bij wavenumbers ongeveer 1600-1900 cm-1 (5263 nm tot 6250 nm).
kernspinresonantie
De koolstof-NMR van carbonylkoolstof vertoont een piek van ongeveer 160-220 ppm.
