De D – en L – notatie voor de Absolute configuratie van suikers en aminozuren
Wat onderscheidt “D-Glucose “van” L-Glucose”? Of D-alanine van L-alanine?
en wat is deze D – en L – nomenclatuur eigenlijk? Lees verder:
inhoudsopgave
- D – en L – geeft een snelle afkorting voor het aanwijzen van enantiomeren
- Waarom houden we ons bezig met deze oude nomenclatuur?,
- het L – en D – systeem voor het toewijzen van”Absolute configuratie”
- Vier-Koolstofaldehyde D – en L – suikers (Aldotetroses)
- vijf-Koolstofaldehyde D – en L – suikers (Aldopentoses)
- zes-Koolstofaldehyde D – en L – suikers (Aldohexoses)
- maar wacht – er is meer! (Aminozuren)
- samenvatting: D – en L – notatie voor suikers en aminozuren
- noten
- (geavanceerde) referenties en verdere lezing
D – en L – biedt een snelle steno voor de aanwijzing van enantiomeren
D – en L – notatie biedt een snelle steno voor de aanwijzing van enantiomeren.,
D-Glucose is bijvoorbeeld het enantiomeer van L-Glucose. Aangezien L-Alanine de enantiomeer van D-Alanine is.
Het wordt als volgt toegewezen. Voor een suiker die in de Fischer-projectie wordt getrokken met de meest geoxideerde koolstof aan de bovenkant (dat wil zeggen aldehyde of keton)
- als de OH in het onderste chirale centrum naar rechts wijst, wordt het aangeduid als D-
- als de OH in het onderste chirale centrum naar links wijst, wordt het aangeduid als L- .
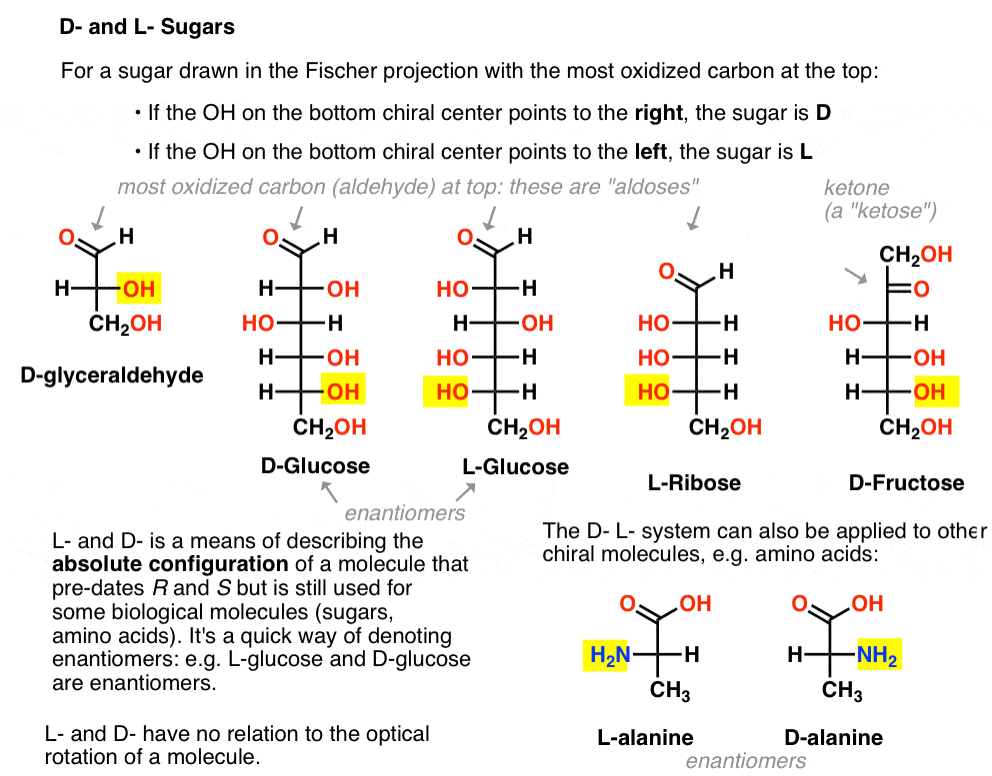
deze terminologie kan ook worden toegepast op aminozuren: zie L – en D – alanine in de afbeelding hierboven.,
2. Waarom Houden We Ons Bezig Met Deze Oude Nomenclatuur?
u kunt zich terecht afvragen: hebben we niet al een systeem voor het toewijzen van absolute configuratie ? Waarom hebben we een nieuw systeem nodig?
Het D-L systeem is geen nieuw systeem, mensen. Het is het oude systeem-het dateert van voor Cahn-Ingold-Prelog.het D-L-systeem is letterlijk een overblijfsel van het paard-en-buggy tijdperk, dat teruggaat tot Emil Fischer ‘ s werk over koolhydraten in de late jaren 1800 – een tijd waarin organische chemici geen manier hadden om de absolute configuratie van stereocenters te bepalen, wat pas mogelijk werd in 1951 (thx, Bijvoet).,
dus waarom wordt het nog steeds gebruikt? Moet het niet worden verzonden naar de vuilnisbak van de geschiedenis, samen met slide regels, 8-track cassettes, en 5 ¼ ” floppy disks?
Nou, er zijn bloeiende gemeenschappen in delen van het Amerikaanse platteland waar paardenkarren blijven bestaan-als je weet waar je moet zoeken. (Misschien zullen er ooit communes zijn waar mensen alleen computertechnologie uit de jaren zeventig en tachtig gebruiken?)
ook is er een pocket van organische chemie waar D-L systeem nog steeds gebruik van vindt, en dat is specifiek in het rijk van suikers en aminozuren.,dit is overigens geen opstand van Amish chemici tegen het moderne kwaad van het CIP-systeem. In het specifieke geval van suikers en aminozuren zijn er ten minste drie goede redenen om L – en D- :
- beknoptheid te gebruiken. D-glucose is een stuk sneller te schrijven en te zeggen dan (2R,3S,4R,5R)2,3,4,5,6-pentahydroxyhexanal. Het L – / D-systeem zorgt ervoor dat de configuratie van een molecuul met meerdere chirale centra kan worden samengevat met een enkele letter (plus de gemeenschappelijke naam, natuurlijk – dankzij Noel voor de herinnering)
- meer beknoptheid., Het is toevallig een snelle manier om naar enantiomers te verwijzen. De enantiomeer van L-glucose is D-glucose. De enantiomeer van L-tryptofaan is D-tryptofaan. En terwijl wij de (+)- of (–)- voorvoegsels konden gebruiken om de twee enantiomers van glucose en andere suikers te onderscheiden, kan het teken van optische rotatie met oplosmiddel, temperatuur, concentratie, en andere factoren variëren die het minder dan ideaal maken. Plus, L – en D-verwijzen specifiek naar absolute configuratie, terwijl (zoals we eerder opgemerkt) er geen eenvoudige relatie is tussen het teken van optische rotatie en configuratie.,
- blijkt dat de meeste van nature voorkomende suikers D-zijn en de meeste van nature voorkomende aminozuren L -. Er is een enorme hoeveelheid informatie gecomprimeerd in dat statement, en er is geen concurrerend systeem (R/S, +/–) dat de L – en D – zou kunnen vervangen door een enkel teken. Noot
het verdient herhaling: met suikers en aminozuren kunnen L – en D – nuttige benamingen zijn. Voor andere moleculen kun je het grotendeels vergeten.
dus wat is dit D – / L-systeem, en hoe verhouden deze termen zich tot structuur?,
Join me as we travel back through time …
het L – en D – systeem voor het toewijzen van “Absolute configuratie”
Emil Fischer begon eind 1880 met het bestuderen van koolhydraten. het was toen bekend (via Van ‘ t Hoff) dat koolstof tetrahedraal was, en het was ook bekend dat moleculen die koolstof bevatten met vier verschillende substituenten vlak-gepolariseerd licht konden roteren (bijvoorbeeld Pasteur). Wat niet bekend was, was de absolute configuratie van een van de chirale moleculen – waar we vandaag naar verwijzen als hun “R” en “S” configuraties.,
het eenvoudigste koolhydraat dat een chiraal centrum bevat is glyceraldehyde, c3h6o3. Glyceraldehyde heeft drie koolstofatomen, waardoor het een “triose” is. De meest geoxideerde koolstof in glyceraldehyde is een aldehyde, waardoor het ook een “aldose”.
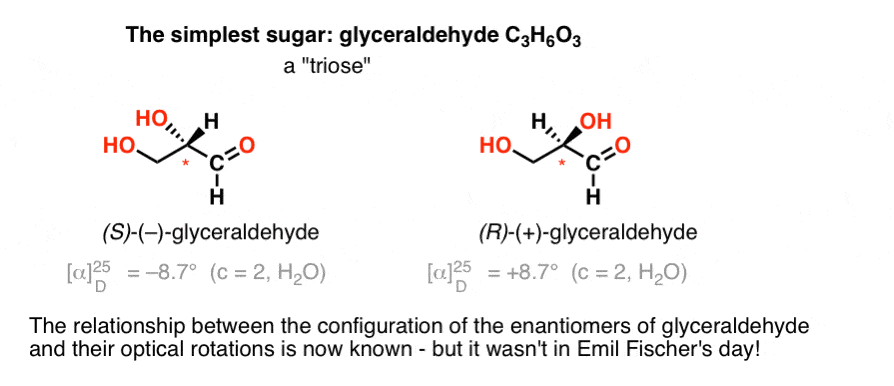
in 1888 waren de twee enantiomeren van glyceraldehyde geïsoleerd en gekarakteriseerd., Maar omdat er geen eenvoudige correlatie is tussen de configuratie van een chiraal centrum en de richting waarin het vlak-gepolariseerd licht roteert, kon Emil Fischer de optische rotatie van (+)- en (–)-glyceraldehyde niet koppelen aan de absolute configuratie van de atomen rond het chiraal centrum.
volgens de huidige terminologie kon hij niet weten of (–)-glyceraldehyde (R) of (S) was.
bij gebrek aan dit belangrijke stukje informatie, koos Fischer om te raden.,
de gok, die juist bleek te zijn, was dat (- )- glyceraldehyde de configuratie had die we nu s noemen, en dat (+) – glyceraldehyde de configuratie heeft die we nu R.
natuurlijk waren Cahn, Ingold en Prelog nog niet geboren, en het CIP-systeem zou pas ontwikkeld worden na het werk van Bijvoet in 1951. Dus Fischer ontwikkelde zijn eigen nomenclatuur.
tekenen van glyceraldehyde in wat later de Fischer –projectie zou worden genoemd, gaf hij de configuratie aan de linkerkant aan (- ) – glyceraldehyde, en noemde het L- (afkorting voor Latijn laevo )., Vervolgens gaf hij de configuratie rechts aan (+)-glyceraldehyde, en noemde het D – (voor Latijnse dextro ).
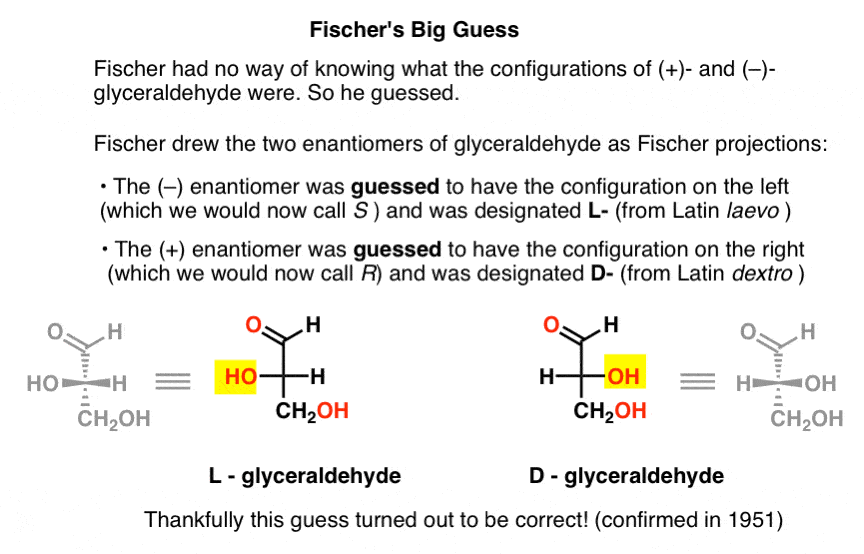
Waarom is dit zo belangrijk?
Het toewijzen van de absolute configuratie voor L – en D – glyceraldehyde was een beetje zoals het toewijzen van de nulmeridiaan (0° Lengtegraad) aan de Royal Observatory in Greenwich, Engeland., Net zoals de lengtegraad van elke andere plaats op aarde dan kon worden bepaald ten opzichte van dat punt als hun relatieve afstanden bekend waren, kon de absolute configuratie van elk ander stereocenter dan worden bepaald als zijn configuratie ten opzichte van L – of D – glyceraldehyde bekend was.
dat is misschien niet de duidelijkste analogie. Dus laten we eens kijken naar de 4-koolstof suikers voor een ander voorbeeld.,
Vier Koolstofaldehyde D – en L – suikers (Aldotetrosen)
zodra de absolute configuraties van L – en D – glyceraldehyde werden voorgesteld, konden de absolute configuraties van andere chirale verbindingen vervolgens naar analogie worden vastgesteld (en veel chemisch werk).
Het is niet cruciaal voor vandaag, maar voor een voorbeeld van dit soort redeneren, zie dit .
toen het concept van chirale centra werd geïntroduceerd, leerde u waarschijnlijk dat een molecuul met n chirale centra 2N stereoisomeren zal hebben (zolang er geen meso-verbindingen zijn).,
Er zijn twee vier-koolstofaldosen, threose en erytrose. Ze hebben elk twee chirale centra. Elk bestaat als een paar enantiomeren (L-en D -) die vier stereoisomeren in totaal geven.
Hier zijn ze. Het belangrijkste om op te merken in de onderstaande figuur is dat de l-familie van suikers de OH groep van de onderste chirale koolstof aan de linkerkant heeft, en de D-familie heeft de OH groep van de onderste chirale koolstof aan de rechterkant (gemarkeerd).,
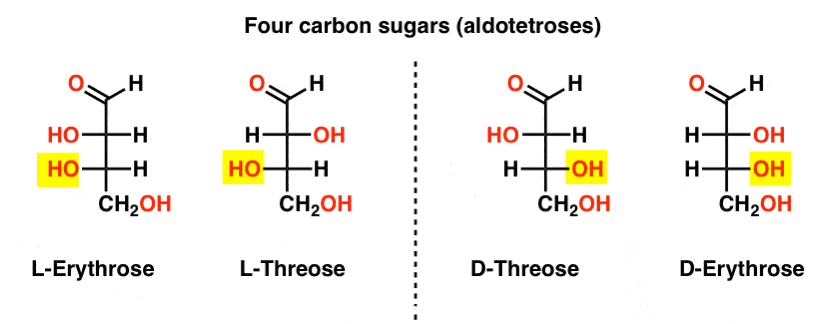
zie hoe L-Erytrose en L-Threose bouwen op het stereocenter dat is gevestigd in L-glyceraldehyde (gemarkeerd), en D-Erythrose en D-Threose bouwen op het stereocenter dat is gevestigd in D-glyceraldehyde (gemarkeerd).
suikers zijn een beetje opgebouwd zoals het binaire systeem; je kunt denken dat elk stereocenter een “bit” is dat één van de twee waarden kan hebben. De configuratie van L-erythrose en L-threose verschilt slechts op één stereocenter. Als we de positie van H en OH omdraaien, krijgen we de andere., Deze relatie heeft een naam die je soms zou kunnen zien: twee moleculen die de tegenovergestelde configuratie hebben bij slechts één stereocenter worden epimers genoemd, vooral wanneer een van de atomen die aan het stereocenter zijn verbonden een waterstof (H) is.
vijf Koolstofaldehyde – D-en-L-suikers (Aldopentoses)
de meest bekende naam op die lijst moet ribose zijn, de suikerrub van ribonucleïnezuur (RNA).
aan de linkerkant in het diagram hieronder, hebben we de l-aldopentoses, die allemaal dezelfde configuratie van het onderste stereocenter delen wanneer het aldehyde bovenaan wordt geplaatst.,
hun enantiomeren, de D-aldopentoses, bevinden zich aan de rechterkant, die allemaal dezelfde configuratie van het onderste stereocenter hebben (gemarkeerd).
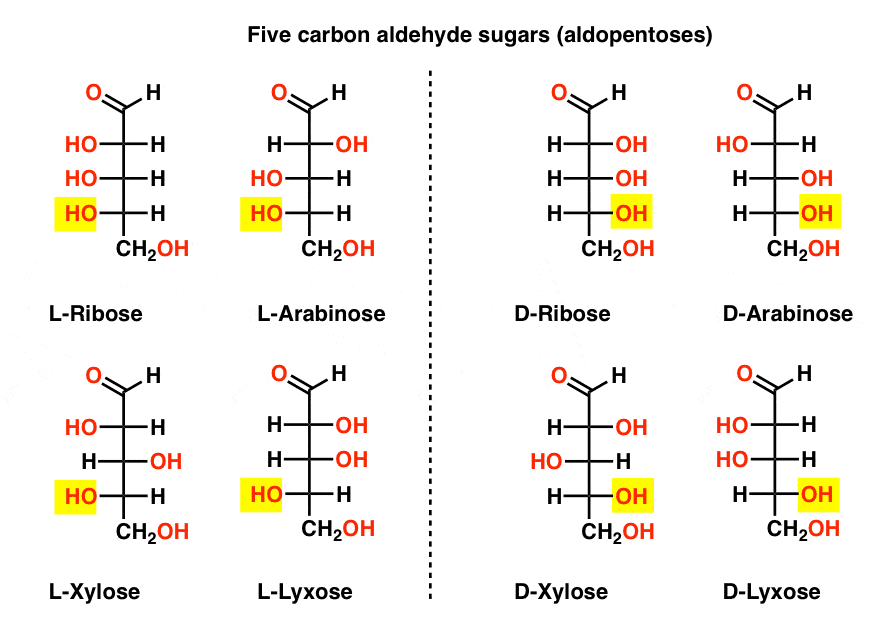
Op dit punt moeten we erop wijzen dat de overgrote meerderheid van suikers in aardse levensvormen D-suikers zijn, met inbegrip van D – ribose als de ruggengraat van RNA. Waarom en hoe alle organismen op aarde aan d-suikers zijn gekomen is een raadsel, want men veronderstelt dat L-suikers net zo goed zouden hebben gewerkt.,
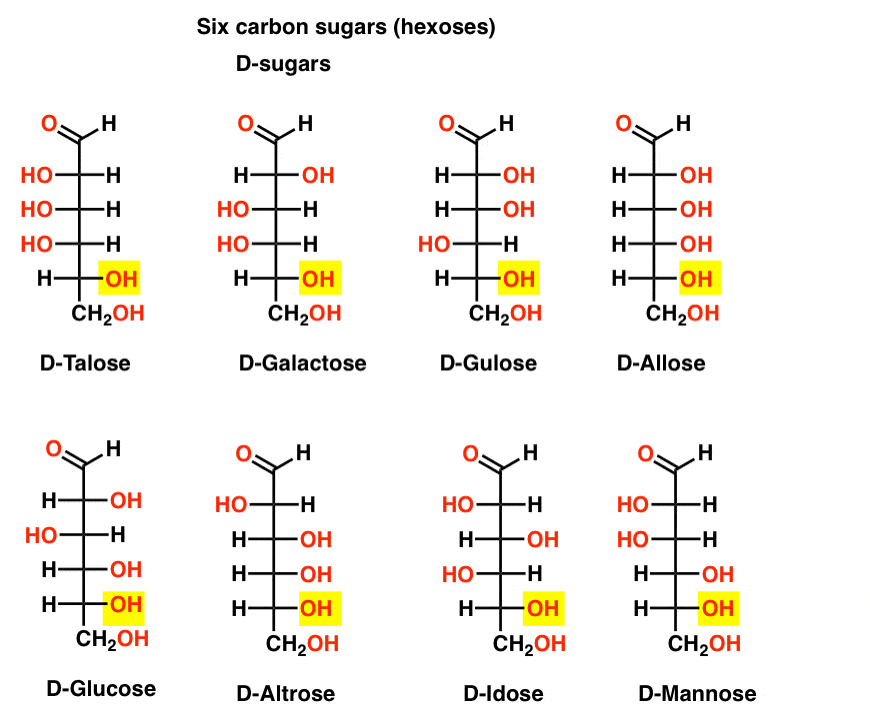
zes Koolstofaldehyde D – en L-suikers (Aldohexoses)
als er 4 aldopentoses zijn, elk als een D – L-paar enantiomeren (8 stereoisomeren totaal), hoeveel aldohexoses zijn er dan?
er zijn 8 D – L-paren (16 stereoisomeren totaal). De meest bekende is glucose, maar je herkent waarschijnlijk mannose en galactose. Sommige zijn zelden, of ooit, te vinden in de natuur (idose, iemand?).
Hier zijn de D-aldohexoses. Merk op dat ze allemaal dezelfde configuratie hebben van het onderste chirale centrum – dezelfde die we zagen in D-glyceraldehyde.,
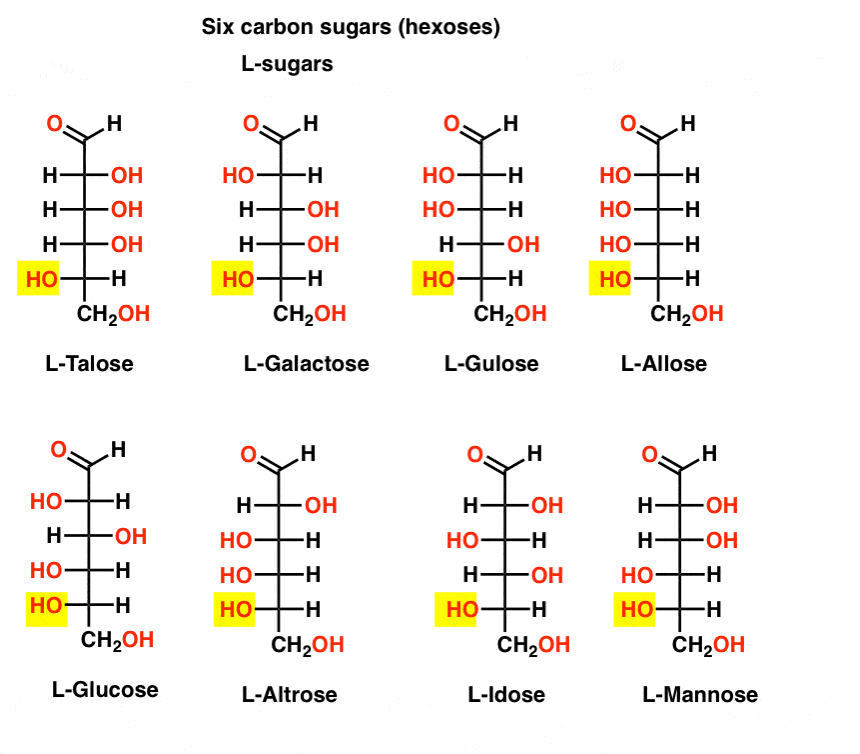
in tegenstelling tot de D-suikers worden de L – suikers (hieronder) zelden in de natuur aangetroffen. Interessant is dat L-glucose is onderzocht als suikervervanger. De smaak is niet te onderscheiden van natuurlijk voorkomende D-glucose, maar biedt geen voeding omdat het niet kan worden afgebroken door onze (chirale) enzymen. Het blijkt dat de productie gewoon te duur is om te concurreren met splenda, stevia, aspartaam et. al.
OK, dat is genoeg. Zeven-koolstof suikers zijn gemaakt (aldoheptoses), maar ze zijn biologisch niet significant.,
7. Maar wacht, er is meer! (Aminozuren)
als je aminozuren in de Fischer projectie tekent met de meest geoxideerde groep bovenaan (het carboxylzuur) dan kun je ook L – en D-toewijzen.
van de 19 chirale aminozuren die in eiwitten zijn opgenomen (proteïnogeen is de juiste term) zijn alle L- . (Glycine is achiraal, dus D – en L-zijn niet van toepassing). Sommige D-aminozuren komen van nature voor, maar ze zijn zeldzaam (meestal gevonden in bacteriën, met de opmerkelijke uitzondering van platypusgif) en worden niet gecodeerd door mRNA.,
interessant is dat, hoewel alle 19 chirale aminozuren L – zijn , slechts 18 van de 19 zijn (S). Wat is de uitzondering?
(Dit is goede organische chemie bar trivia).
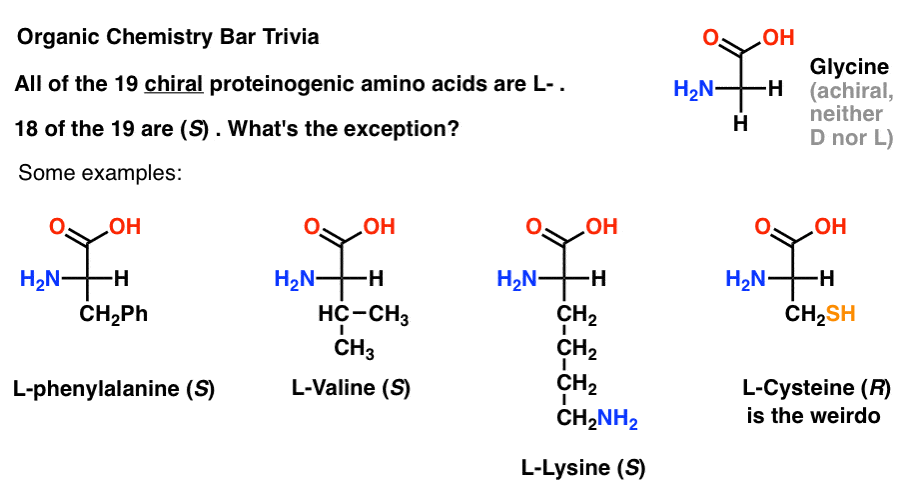
cysteïne is de weirdo.
(bonuspunten als je ook selenocysteine zei … nerd).
samenvatting: D – en L-notatie voor suikers en aminozuren
dus dat is het D – L-systeem voor toewijzing van absolute configuratie. Het werkt goed voor suikers omdat ze zo systematisch kunnen worden opgebouwd (zoals het binaire systeem). Het is ook nuttig voor aminozuren., Het belangrijkste punt is om naar het onderste stereocenter te kijken terwijl het in de Fischer-projectie wordt getekend. Toch? D. Weg? L.
natuurlijk worden suikers niet altijd zo nuttig getrokken in Fischer – projecties-ze vormen ringen. We zullen schrijven over het bepalen van D – en L-in cyclische suikers in een volgende post.het enige wat ik te zeggen heb is, dank de godheid die je kiest om te geloven in dat Fischer ‘ s gok correct bleek te zijn. Het zou een enorme pijn in de kont om te ziften door meer dan 70 jaar van de chemische literatuur wetende dat de verkeerde configuratie was toegewezen aan alle suikers en aminozuren.,
Met dank aan Thomas Struble voor hulp bij deze post.
noten
Noot 1. “het voorlaatste stereocenter in de meeste chirale suikers is R, terwijl het stereocenter in de meeste aminozuren S is” heeft niet helemaal dezelfde ring, vooral omdat cysteïne R. ]
Note. Hier is een gedachte-experiment voor het bepalen van de relatieve configuraties van erythrose en threose., (Ik zeg “gedachte-experiment” omdat ik geen specifieke reagentia wil opnemen, die storend kunnen zijn)
als men begint met pure (+)-erytrose en de primaire alcohol oxideert tot een aldehyde met behulp van bekende methoden, verkrijgt men een verbinding zonder optische rotatie. Hetzelfde geldt voor (- ) – erythrose, die een volledig identieke verbinding retourneert. Hieruit kan worden afgeleid dat de structuur van de nieuwe verbinding zodanig moet zijn dat het molecuul een inwendig spiegelvlak heeft (dat wil zeggen dat het meso is). .,
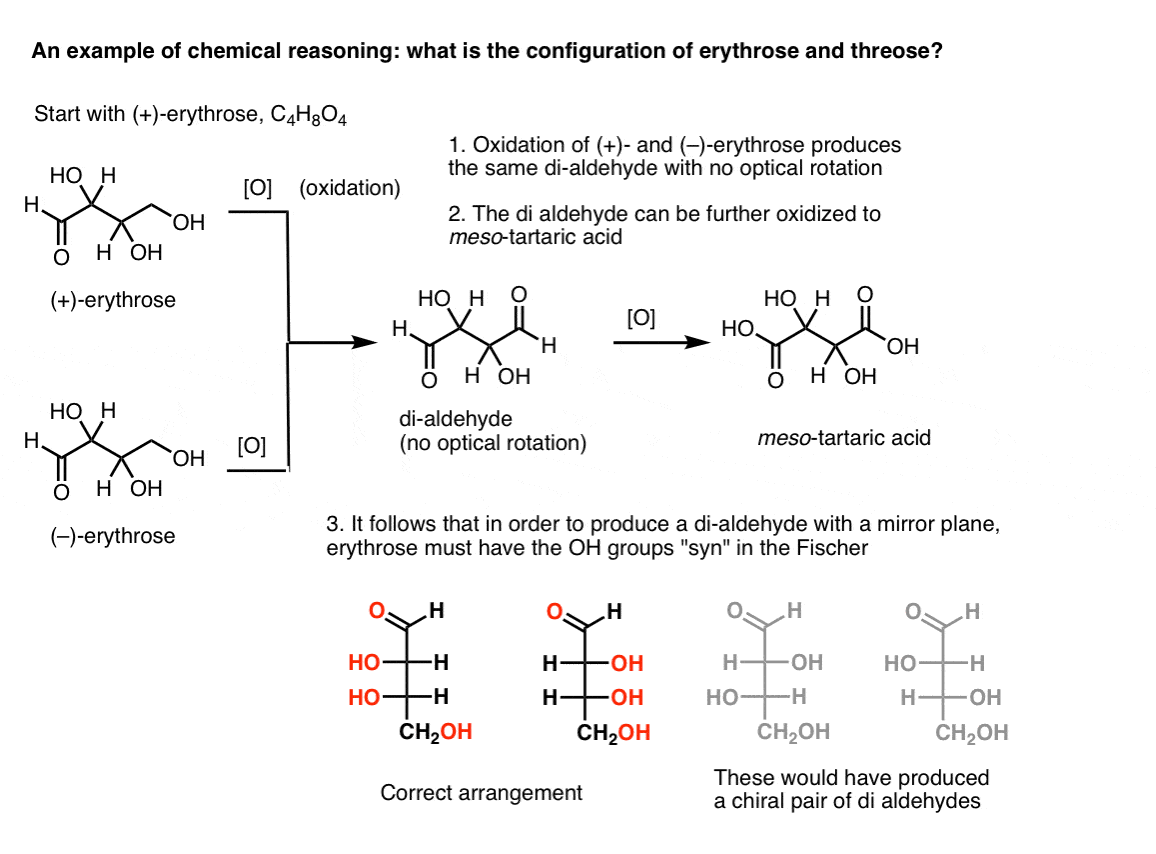
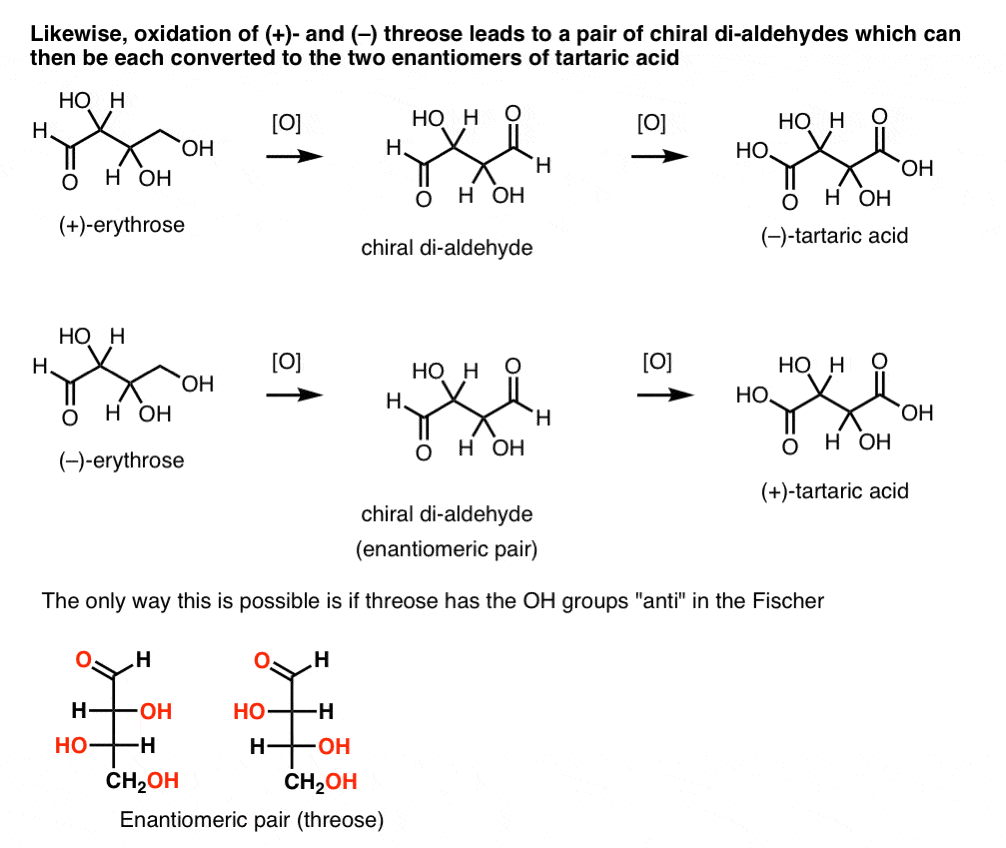
daarentegen resulteert het uitvoeren van dezelfde bewerking op (+)-threose in een dialdehyde dat optische rotatie behoudt. Een verbinding met gelijke en tegengestelde optische rotatie wordt gevormd door het uitvoeren van dezelfde operatie op (–)-threose. Deze twee samenstellingen zijn enantiomeren. Om dat waar te laten zijn, moet de relatieve oriëntatie van de hydroxylgroepen in threose anti zijn. Deze verbindingen kunnen verder worden geoxideerd tot respectievelijk (–)- en (+)- wijnsteenzuur.,
dezelfde redenering kan in de tegenovergestelde richting worden gebruikt (reductie). Zo kan (+)- of (–)- erythrose worden gereduceerd tot het TETRA-ol erythritol, dat meso is.
de reductie van (+)- en (–) threose resulteert eveneens in een enantiomeer paar tetra-ols, threitol.
uit deze feiten kunnen we de relatieve oriëntatie van de OH-groepen afleiden.
(Advanced) References and Further Reading
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d und l
Emil Fischer
Ber. 1907, 40 (1), 102-106 DOI: 10.,1002 / cber.19070400111 dit is het beroemde artikel waar Prof. Emil Fischer (willekeurig!) toegewezen ( – ) – glyceraldehyde de l-stereochemie.Syntheses in the Purine and Sugar Group Emil Fischer Nobel Lecture, 1902 Fischer ‘ s Nobel Lecture, waarin hij vertelt over zijn werk, niet alleen in koolhydraten, maar ook in purines, waarvan verbindingen als cafeïne en theobromine lid zijn. Prof. Fisher voorspelt de opkomst van energiedranken (bijv., Red Bull), waarin staat: “met de oefening van een beetje verbeelding de dag kan worden voorzien wanneer bonen niet langer nodig zijn om goede koffie te maken: een kleine hoeveelheid poeder uit een chemische werkt samen met water zal een hartige, verfrissende drank verrassend goedkoop”. - Determination of the Absolute Configuration of Optically Active Compounds by Means of X-Rays
Bijvoet, J., PEERDEMAN, A. & van BOMMEL, A.,Nature 1951, 168, 271-272 DOI: 1038 / 168271a0 The famous paper that proved, using X-ray structural analysis, that “Emil Fischer’ s convention, which assigned the configuration of Fig. 2 aan het dextrorotatoir zuur, lijkt te beantwoorden aan de werkelijkheid”. - Emil Fischer ‘ s discovery of the configuration of glucose. A semicentennial retrospect C. S. Hudson Journal of Chemical Education 1941, 18 (8), 353 DOI: 10.1021/ed018p353 An early review that covers Prof.Emil Fischer ‘ s work in carbohydrate chemistry.,Emil Fischer ‘ s Proof of the Configuration of Sugars: A Centennial Tribute Frieder W. Lichtenthaler Angew. Scheikunde. Int. Ed. 1992, 31 (12), 1541-1556 DOI: 10.1002/anie.Een zeer leesbaar overzicht uit 1992 dat Prof. Fischer ‘ s werk in de koolhydraatchemie behandelt en dieper ingaat op de stereochemische opdrachten van koolhydraten.
