introductie
telomeren zijn nucleoproteïnestructuren aan de uiteinden van lineaire eukaryotische chromosomen. Ze lossen twee grote eindproblemen tegelijkertijd op. De eerste gaat over de bescherming van het chromosoomeinde. Geschat wordt dat normale menselijke cellen ten minste 50 endogene double-stranded breaks (dsbs) per cel per celcyclus moeten herstellen (Vilenchik en Knudson, 2003)., Telomeres onderscheiden de natuurlijke chromosomale einden van schadelijke DSBs en verhinderen hun ectopische reparatie, b. v. door eind-aan-eind fusies van chromosomen (vansteensel en deLange, 1997). De tweede is het eind-replicatie probleem dat zich bezighoudt met het onderhoud van de juiste telomeer lengtes. Dit werd onafhankelijk erkend door twee onderzoekers (Watson, 1972; olovnikov, 1973). Aangezien de replicatieve DNA-afhankelijke polymerases van DNA de synthese van DNA aan de uiteinden van chromosomen niet kunnen voltooien, moet de compensatie voor het verlies van de replicatieve telomeervolgorde van een RNA-afhankelijke polymerase van DNA komen., Dit enzym, genaamd telomerase, werd samen met de eerste telomeer minisatellietsequentie ontdekt in het ciliaat Tetrahymena (Blackburn and Gall, 1978; Greider and Blackburn, 1985). Echter, dit is slechts een aspect van telomere lengte onderhoud. De epigenetische regulatie van de homeostase van de telomeerlengte, met inbegrip van interactie van lange noncoding telomeric herhaling die RNA en exonuclease activiteit wegen bevatten, zijn ook uitgebreid bestudeerd wegens zijn therapeutisch potentieel (Wellinger et al., 1996; Polotnianka et al., 1998; Pfeiffer and Lingner, 2012).,
Telomerase, het enzym dat verantwoordelijk is voor het toevoegen van telomeerrepectoren aan het 3′ uiteinde van telomeren, is een geconserveerd complex enzym met talrijke componenten . In principe zijn slechts twee hoofdcomponenten essentieel voor telomerase enzymatische activiteit, een katalytisch actieve eiwitcomponent, genoemd telomeer reverse transcriptase (TERT), en een templatecomponent, gevormd door de telomerase RNA subeenheid (TR). Terwijl tert evolutionair vrij goed geconserveerd is, is TR zeer variabel, met lengtes variërend van ca. 150 nt (Tetrahymena) tot meer dan 2000 nt (schimmels uit het geslacht Neurospora)., Slechts een kort gebied in het gehele TR-molecuul dient als sjabloon voor nieuw samengesteld telomeer-DNA (Greider and Blackburn, 1985; Qi et al., 2013). Dit gebied in TR wordt gewoonlijk gevormd door een volledig telomeermotief dat door een gedeeltelijke wordt gevolgd, laatstgenoemden dienend als onthardend gebied voor het bestaande telomeerdna. Hoewel in principe slechts één extra nucleotide nodig is (als een partieel motief), wordt er meestal meer dan één gevonden. Bijvoorbeeld, twee extra nucleotiden vormen het gloeien motief in muizen of vijf in de mens (Blasco et al., 1995; Feng et al., 1995)., In planten, echter, de grootte van de template regio is variabel, bijvoorbeeld, twee in Arabidopsis thaliana, zeven in Arabis sp. of zes in Nicotiana (Fajkus et al., 2019). De andere TR-gebieden hebben structurele, regelgevende en eiwit interactieve functies . Zie ook een schematische weergave van telomerase en zijn activiteitscyclus in Figuur 1.

figuur 1 schematische weergave van de telomerase-activiteitscyclus met de Arabidopsis-type telomeer template. TERT, Telomere Reverse Transcriptase; TR, telomerase RNA subeenheid., Figuur gebaseerd op Sekhri (2014).
hoe variabel zijn Telomeersequenties?
Telomeersequenties zijn meestal korte minisatellieten tandemly gerangschikt, meestal volgens de formule (TxAyGz)n. de minisatelliet rangschikking komt voort uit de manier waarop telomerase synthetiseert het DNA, in korte, en meestal identieke motieven, een voor een., Verscheidene hypothesen zijn van mening dat een dergelijke regeling belangrijk is omdat het de erkenning van telomere specifieke proteã nen door homo – en heterodimers en voor het potentieel bevordert om G-quadruplexen te vormen die chromosoomeinden kunnen stabiliseren of als substraten voor telomere-specifieke proteã nen (Spiegel et al., 2020; Tran et al., 2013). De opeenvolgingen van telomeer worden goed behouden door evolutie, en de grote groepen organismen gebruiken Het groep-typisch telomeermotief om hun TELOMEERDNA te bouwen., Een geleidelijk groeiend aantal studies en grote screenings hebben aangetoond dat alle geteste gewervelde dieren en veel basale metazoanen TTAGGG (meyne et al., 1989; Traut et al., 2007) terwijl Euarthropoda (geleedpotigen), waaronder Hexapoda (insecten), ttagg (Frydrychova et al., 2004; Vitkova et al., 2005). Gestaag, tal van uitzonderingen accumuleren in de tijd, bijvoorbeeld (A (G)1-8) in Dictyostelium (Emery and Weiner, 1981), TTAGGC in Ascaris lumbricoides (Nematoda) (Muller et al., 1991), TCAGG in Coleoptera (kevers) (Mravinac et al., 2011), TAGGG/TAAGG / TAAGG in Giardia (diplomonads) (Uzlikova et al.,, 2017), of TTNNNNAGGG in Yarrowia clade (gisten) (Cervenak et al., 2019). Bovendien, telomerase-onafhankelijke systemen, waarin de minisatelliet telomeer sequentie is verloren gegaan en vervangen door complexe herhalingen, worden vertegenwoordigd, bijvoorbeeld, door Diptera en Chironomidae (beoordeeld in (Mason et al., 2016)). Voor een algemeen overzicht op eukaryotic telomere sequentie zie (Fajkus et al., 2005; Fulneckova et al., 2013).
Telomeersamenstelling in planten is nog diverser., Hier gebruiken we de term “planten” in brede zin, ook bekend als Archaeplastida of kingdom Plantae sensu lato, en bestaat uit Rhodophyta (rode algen), Glaucophyta, de Chlorophyt algen grade en de Streptophyt algen grade (geheel bekend als groene algen), en Embryophyta (landplanten) (One Thousand Plant Transcriptomes Initiative, 2019). De typische telomeer plantsequentie is TTTAGGG, ook wel Arabidopsis-type (of gewoon, plant-type) omdat het werd ontdekt in Arabidopsis thaliana (Richards and Ausubel, 1988) en nu in vele andere soorten in bijna alle plantenorden., Hoewel TTTAGGG nog steeds het meest voorkomt, is er significante variabiliteit in telomeersequenties in rode en groene algenlijnen. Zoals voor rode algen (Rhodophyta), telomere sequentie informatie ontbreekt meestal of fragmentarisch, hoewel sommige telomere kandidaten zijn ontdekt in silico, zoals AATGGGGGG voor Cyanidioschyzon merolae (Nozaki et al., 2007), TTATT(T) AGGG for Galdieria sulphuraria (Fulneckova et al., 2013); TTAGGG is gevonden in genomische reads van Porphyra umbilicalis (Fulneckova et al., 2013), maar meer bewijs is nodig om hun eindpositie op chromosomen te bevestigen., De telomeerdiversiteit in groene algen weerspiegelt zowel dynamische veranderingen als zijn paraphyletisch karakter. Hoewel TTTAGGG heerst in Chlorophyta, zoals in de geslachten Ostreococcus (Derelle et al., 2006) en Chlorella (Higashiyama et al., 1995), zijn er ook vele andere afwijkende motieven ontdekt, zoals Ttaggg in het geslacht Dunaliella en Stephanosphaeria (Fulneckova et al., 2012), en TTTTAGGG in Chlamydomonas (Petracek et al., 1990). In basale Streptophyta (Klebsormidiophyceae) zijn progressieve veranderingen in de motieven van TTTAGGG naar TTTAGGG en TTTTAGG beschreven., De aanwezigheid van Ttaggg in Rhodophyta en Glaucophyta leidt tot de hypothese dat dit het voorouderlijke motief in planten is (Archaeplastida) (Fulneckova et al., 2013).
Wat landplanten betreft, bleek uit een van de eerste screenings dat de Arabidopsis-type sequentie de meest voorkomende was en grotendeels behouden werd door hun fylogenie (Cox et al., 1993; Fuchs et al., 1995), hoewel sommige van deze auteurs al enkele uitzonderingen hadden ontdekt in de familie Amaryllidaceae (voorheen Alliaceae), waarin de Arabidopsis-type sequentie afwezig was in verschillende soorten., Later, de eerste telomeer sequentie ongebruikelijk voor landplanten, de gewervelde-type TTAGGG, werd gekenmerkt in aloë en in sommige andere Asparagales (Weiss en Scherthan, 2002; Puizina et al., 2003; Sykorova et al., 2003c). Een hypothese over herhaalde verliezen en terugvorderingen van de tttaggg en ttaggg telomere opeenvolging in Asparagales werd geformuleerd (Adams et al., 2001). Met de nabewerking van de orde Asparagales in de APGIII (Angiosperm Phylogeny Group 2009) (Bremer et al.,, 2009), werd aangetoond dat slechts twee belangrijke evolutionaire schakelaars in een telomeer volgorde samenstelling opgetreden (in plaats van verschillende herhaald verliezen en winsten), in de volgende volgorde: de eerste in de familie Iridaceae, dat een verschuiving van de plant-type TTTAGGG tot de gewervelde-type TTAGGG gebeurd, gevolgd door gezinnen Xeronemataceae, Asphodelaceae en de kern Asparagales (met inbegrip van Amarillidaceae s.l en Asparagaceae s.l.,); en de tweede binnen onderfamilie Allioideae (voorheen behandeld als een aparte familie, Alliaceae) waarin een geheel nieuwe telomeersequentie ontstond, CTCGGTTATGGG (Fajkus et al., 2016). Buiten Asparagales, nieuwe telomeer sequenties zijn ook gedetecteerd in land plant groepen zo ongelijksoortig Als (I) Solanaceae, waarin de telomeer sequentie van Cestrum elegans ttttttaggg werd beschreven (Sykorova et al., 2003a; Sykorova et al., 2003b; Peska et al., 2008; Peska et al.,, 2015) en (ii) Lentibulariaceae, waar genus Genlisea toonde een opmerkelijke diversiteit met sommige soorten gekenmerkt door de Arabidopsis-type telomere herhaalt terwijl anderen tentoongesteld gemengde sequentie varianten TTCAGG en Tttcagg (Tran et al., 2015).
ondanks alle gedetecteerde uitzonderingen op het telomeermotief, wordt de werkelijke diversiteit in telomeersequenties in landplanten waarschijnlijk sterk onderschat. Een recente publicatie (Vitales et al.,, 2017), waarin een screening van landplant telomeersequenties werd uitgevoerd, bleek dat telomeersequenties alleen duidelijk bekend waren voor minder dan 10% van de soorten en 40% van de geslachten in de Plant rDNA-database (www.plantrdnadatabase.com), een bron die moleculaire cytogenetische informatie verstrekt over landplanten (Garcia et al., 2012). A summary of telomere sequence distribution in plants, following APG IV (The Angiosperm Phylogeny Group, 2016) (Byng et al., 2016), evenals de meest recente plant fylogenie (duizend Plant Transcriptomes initiatief, 2019) is te vinden in Figuur 2.,
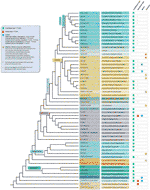
Figuur 2 Telomeermotieven in Archaeplastida (planten in de brede zin), gebaseerd op de APG IV (de Angiosperm Fylogeny Group 2016) en op het One Thousand Plant Transcriptomes Initiative (2019). Vertakkingslengten drukken geen real time schalen uit., Voor de eenvoud en om ruimte te besparen zijn bepaalde polyphyletic “groepen” (rangen) gemarkeerd met een sterretje in de boom weergegeven door een enkele tak; om dezelfde reden zijn verschillende kleine orden (vermeld in het blauwe vierkant aan de linkerkant van de figuur) niet afgebeeld op de boom. Het eerste tip label verwijst meestal naar plantenorders en in een paar gevallen naar afdelingen, klassen en zelfs families; het tweede label toont representatieve families en in een paar gevallen representatieve orden of geslachten.
van Screenings tot Discovery: Hoe kunnen telomere motieven worden geïdentificeerd?,
het bewijs dat een bepaalde kandidaatsequentie een echte telomerische is omvat verschillende stappen die de lokalisatie op alle chromosomale termini correct aangeven, en uiteindelijk de betrokkenheid van telomerase in zijn synthese. De moleculaire cytogenetics (meestal door fluorescentie kruising in situ, vissen) is belangrijk geworden voor het visualiseren van de eindlokalisatie van geëtiketteerde sondes van kandidaatopeenvolgingen bij al chromosomale eindpunten. Echter, standalone vissen is het niet genoeg om de terminale positie te bewijzen., Bijvoorbeeld, AcepSAT356 werd voorgesteld in UI als de telomere kandidaat, gebaseerd op resultaten van VISANALYSE (Pich en Schubert, 1998). Niettemin, is zijn schijnbare eindlocatie door in situ nooit overtuigend verbonden met telomeerfunctie. Eigenlijk zou de ontdekking van de Allium minisatellite telomere sequentie CTCGGTTATGGG en telomerase betekenen dat AcepSAT356 subterminaal is (Fajkus et al., 2019)., De positieve signalen van de vissen telomeric kunnen uiterst kleine veranderingen in telomeermotieven zoals enige nucleotidepolymorfismen ook maskeren, of vals-negatieve resultaten kunnen van korte telomeren resulteren die onder de opsporingsgrens van de techniek zijn.
er zijn twee aanvullende benaderingen die de eindpositie met een grotere resolutie dan FISH bepalen; deze zijn gebaseerd op exonuclease bal31-activiteit., De eerste is de klassieke Eindrestrictiefragment (TRF) analyse, waarin de steekproeven die door BAL31 worden behandeld progressief verkorten van eindfragmenten en een daling van signaalintensiteit met stijgende tijd van exonucleasebehandeling tonen. De daaropvolgende analyse van fragmentlengtes wordt uitgevoerd door Southern-blot hybridisatie (Fojtova et al., 2015). De tweede is vergelijkend genoom skimming (NGS gegevens) van niet-en BAL31-verteerd genomisch DNA, parallel., In de bal31 behandelde dataset, is er een significante ondervertegenwoordiging van telomeeropeenvolgingen, daarom worden de eindopeenvolgingen geà dentificeerd door vergelijking met de onbehandelde dataset, gebruikend bioinformaticshulpmiddelen RepeatExplorer of tandem herhaalt vinder .
de andere belangrijke test van een bepaalde telomeersequentiekandidaat bij een soort is het aantonen van telomeraseactiviteit. In dit, is een nuttige experimentele benadering, die eerst voor menselijke cellen wordt ontwikkeld, het telomere Repeat Amplificatieprotocol (val) (Kim et al., 1994), gevolgd door sequencing van de gedetecteerde producten (Peska et al.,, 2015; Fajkus et al., 2016), die iets minder gevoelig is voor vals-positieve resultaten dan vissen. Al deze methoden, met inbegrip van vissen (Fuchs et al., 1995; Shibata and Hizume, 2011) en anderen zoals slot-blot hybridisatie (Sykorova et al., 2003c), en TRAP (Fulneckova et al., 2012; Fulneckova et al., 2016), kan aan het scherm voor telomeren over brede groepen van complexe organismen, met inbegrip van installaties worden gebruikt., Nochtans, kan slechts een combinatie van geschikte gekozen methodes overtuigend tot een conclusie over de telomere functie van een kandidaatopeenvolging leiden, aangezien de resultaten op één enkele benadering zouden misleidend kunnen zijn. Een vollediger overzicht van de strategieën voor de novo telomere kandidaatsequentie identificatie, met inbegrip van de allereerste poging in Tetrahymena (Greider and Blackburn, 1985) worden samengevat in een methodologisch artikel, met nadruk op de NGS benadering gebruikt in planten met extreem grote genomen (Peska et al., 2017).
Is er homoplasie in Telomeersequenties?,
de voorouderlijke telomeersequentie wordt verondersteld TTAGGG te zijn en is de meest voorkomende in de boom des levens (Fulneckova et al., 2013). Toch lijkt het duidelijk dat de frequentie van homoplasie in de evolutie van het telomeermotief relatief hoog is. Bijvoorbeeld, korte, eenvoudige motieven zoals de plant-type TTTAGGG zijn onafhankelijk en herhaaldelijk verschenen in cryptomonaden, oomycete schimmels, en alveolaten; evenzo, de gewervelde-type TTAGGG is secundair ontstaan in bepaalde groepen planten (Asparagales, Rodophyta en Chlorophyta algen) (Sykorova et al., 2003c; Fulneckova et al.,, 2012; Fulneckova et al., 2013; Somanathan en Baysdorfer, 2018). De reden dat sommige opeenvolgingen van telomeer vaker dan andere, gewoonlijk complexere opeenvolgingen zijn naar voren gekomen is waarschijnlijk verwant aan selectiedruk, die nauwkeurigheid voor een bepaalde opeenvolging-specifieke DNA-eiwitinteractie zou bevorderen (Forstemann et al., 2003). Als er een verandering in elk telomeermotief was, zou de interferentie in de telomere nucleoproteïnestructuur noodzakelijkerwijs tot genoominstabiliteit leiden., Dit is de reden telomeersequenties zo evolutionair stabiel zijn, bestaande uit zeer weinig nieuwe en succesvolle sequenties, een patroon consistent met het idee van herhaalde verliezen en de opkomst van de typische telomeersequenties, zoals voorgesteld voor Asparagales (Adams et al., 2001).
het vinden van homoplasie in telomeersequenties roept de vraag op, wat zijn de moleculaire oorzaken en processen die plaatsvinden tijdens deze verschuivingen? Een verandering in telomeersequentie, ondanks schijnbare triviale in sommige gevallen (bijv.,, één extra T), kan ernstige interferentie met genoomintegriteit veroorzaken, wegens een verstoord evenwicht in de telomere DNA-eiwitinteractie. Het is ook onduidelijk of een verandering in telomeersequentie enig evolutionair voordeel kan hebben; in dit opzicht, (Tran et al., 2015) stelde voor dat de verschijning van een “methylable” cytosine in een G-rijke telomere bundel de mogelijkheid van verordening door epigenetische wijziging zou opheffen.
Wat zijn de moleculaire redenen voor veranderingen in de Telomeermotieven?,
om de verandering van de telomeersequentie te verklaren, is de eerste kandidaat de template-subeenheid van telomerase, telomerase RNA (TR). Eerder geà dentificeerde TR van gist en gewervelde dieren behoort tot een verschillende Groep afschriften, waarvan de verbindende eigenschap was dat zij door polymerase II van RNA (Pol II)—in allen maar ciliates werden getranscribeerd; dit gebruikte om de enige uitzondering van afschriften van Pol II vóór publicatie van de identificatie van tr van de landinstallatie te zijn . Door het relatief lange telomeermotief van Allium te gebruiken om te zoeken naar zijn TR binnen de totale RNA-sequentie data pool, Fajkus et al., (2019) toonde aan dat een eerder gekenmerkt noncoding RNA betrokken bij de spanningsreactie in A. thaliana, genoemd AtR8, inderdaad de telomerase RNA subeenheid (Wu et al., 2012; Fajkus et al., 2019). Het was een transcript van RNA-polymerase III (Pol III) met de bijbehorende regulerende elementen in de promotorstructuur. Lange tijd verwachtten onderzoekers dat plant TR zo divergent zou zijn dat het onmogelijk zou zijn om het te identificeren op basis van een homologie-zoekopdracht (Cifuentes-Rojas et al., 2011)., Echter, een zekere mate van gelijkenis werd met succes gebruikt om een gemeenschappelijke TR te identificeren in verschillende Allium soorten met vergelijkende Blast. Verrassend genoeg leidden sequentiehomologie, de aanwezigheid van dezelfde regulerende elementen en een overeenkomstige template regio tot de identificatie van TRS in Allium, Arabidopsis en meer dan 70 andere ver verwante planten, waaronder die met uiteenlopende telomeermotieven zoals Genlisea, Cestrum en Tulbaghia., Voor zover wij weten, zijn er nog steeds geen gegevens over algen TR, die zouden verklaren of Pol III transcriptie van TR een algemeen kenmerk is voor alle planten of niet. Dit werk (Fajkus et al., 2019), gebaseerd op CRISPR knock-out en andere experimenten, toonde ook aan dat een eerder geà dentificeerde telomerase RNA-kandidaat in A. thaliana (Cifuentes-Rojas et al., 2011; Beilstein et al., 2012) was geen functionele template subeenheid van telomerase, zoals kort daarna ook werd aangetoond door (Dew-Budd et al., 2019)., Ervan uitgaande dat de Pol II/Pol III-afhankelijkheid voor TR-transcriptie een betrouwbare evolutionaire marker is, zal toekomstig TR-onderzoek in andere belangrijke eukaryotische lijnen waarschijnlijk nieuwe inzichten openen in de oorsprong van eukaryoten. Telomerase genen en telomeer sequenties zijn niet herkende bronnen van informatie in deze richting, en het vinden van een Pol III afhankelijke TR biogenese route in ciliate en plant lijnen kan de eerste stappen in deze richting vertegenwoordigen (Greider and Blackburn, 1989; Fajkus et al., 2019).
hoe werden chromosomen lineair?,een grote meerderheid van de prokaryoten bevat cirkelvormige chromosomen, terwijl lineaire chromosomen de regel zijn in eukaryoten., Daarom zijn er twee mogelijke scenario ‘ s waarin ofwel (i) linearisatie werd uitgevoerd door een primitieve telomerase, voorafgaand aan andere processen die leidden tot de huidige lineaire chromosomale kenmerken en functies of (ii) linearisatie van een pre-eukaryotic cirkelvormige chromosoom was aanvankelijk telomerase onafhankelijk, maar net voordat de huidige eukaryotes diverged, een primitieve telomerase begon te bezetten chromosoomeinden en werd essentieel voor de nieuw gevormde lineaire chromosomen (Nosek et al., 2006). Villasante et al., (2007) stelde een evolutionair scenario voor waarin de breuk van het voorouderlijke prokaryotic cirkelchromosoom een omzettingsmechanisme bij de einden van DNA activeerde, toestaand de vorming van telomeren door een recombinatie-afhankelijk replicatiemechanisme: gevolgen van deze hypothese leidden tot de verrassende conclusie dat eukaryotic centromeren uit telomeren werden afgeleid.
interessant is dat het tegenovergestelde proces van linearisatie, d.w.z. de vorming van cirkelchromosomen (ook wel ringchromosomen genoemd) van tijd tot tijd is ontstaan tijdens de evolutie van eukaryoten, hoewel zeer onstabiel., Bijvoorbeeld, in het geval van Amaranthus tuberculatus, ringchromosomen verschenen als een stress-geïnduceerde reactie, die resistentie tegen een herbicide (glyfosaat) dragen; deze extra ringchromosomen vertoonden geen hybridisatie met telomeersondes in de karyotype analyse (Koo et al., 2018). Het bijna universele telomerasesysteem en de uitzondering van cirkelchromosomen in eukaryotes staan ons niet toe om één hypothese over andere te steunen., Nochtans, worden de nieuwe combinatiemachines gebruikt in het alternatieve verlengen van telomeres (ALT), een telomerase-onafhankelijke weg, verbonden aan bepaalde menselijke kanker (Zhang et al., 2019), is al aanwezig in prokaryotes. Bovendien is er bewijs van chromosoom linearisatie die onafhankelijk voorkomen in verschillende prokaryote lijnen (Ferdows en Barbour, 1989; Nosek et al., 1995; Volff and Altenbuchner, 2000). Daarom lijkt de hypothese dat het eerste lineaire eukaryotic chromosoom (afkomstig van een prokaryote voorouder) telomerase-onafhankelijk was waarschijnlijker., Er zijn enkele voorbeelden die laten zien dat het telomerase-gebaseerde systeem niet essentieel is voor telomeer onderhoud in alle eukaryotes: retrotransposons in Drosophila telomeren, satelliet herhalingen in Chironomus, een ander insect (Rubin, 1978; Biessmann en Mason, 2003), en ALT in telomerase-negatieve menselijke kanker (Hu et al., 2016; Zhang et al., 2019). Toch kunnen sommige van deze systemen niet zo verschillend zijn, en misschien een gemeenschappelijke oorsprong delen: in Drosophila, is het telomeeronderhoud, gebaseerd in retrotranspositie, niet te onderscheiden van het telomerase-gebaseerde mechanisme (Danilevskaya et al.,, 1998), wat leidt tot de hypothese dat de telomerase zelf een voormalig retrotransposon kan zijn. Maar zeker, telomerase-negatieve plantensoorten zijn tot op heden niet ontdekt en alle uitzonderingen, waarin de typische plant-type telomeer afwezig was, werden later aangetoond dat verschillende, maar nog steeds telomerase-gesynthetiseerde, motieven hebben. Niettemin is de Alt-machine aanwezig in installaties parallel aan de telomerase-activiteit (Watson and Shippen, 2007; Ruckova et al., 2008). Interessante vragen over de rol van telomerase, telomeren en hun onderhoud in plantentumoren komen daaruit voort., Een aantrekkelijke is over de afwezigheid van metastase in planten, ondanks de aanwezigheid van ALT, misschien gerelateerd aan plant Weefsel rigiditeit of ander immuunsysteem dan bij dieren (Seyfried en Huysentruyt, 2013).
hoewel we steeds meer kennis van telomeerbiologie verwerven, zijn we nog steeds niet in staat om de opkomst van telomerase in eukaryoten te verklaren., Het huidige bewijsmateriaal steunt de hypothese dat de opkomst van eukaryotes samen met hun lineaire chromosomen, telomeres, en telomerase aan het verschijnen van spliceosomal introns in archaeal gastheren was gerelateerd (Koonin, 2006; Fajkus et al., 2019). De gelijkenis tussen TERT en andere retroelements is al enige tijd besproken (Pardue et al., 1997). Opmerkelijk is dat uit een relatief recente studie is gebleken dat TERT, als waarschijnlijk lid van nageslacht groep II introns, sequentieel dicht bij Penelope-achtig element retrotransposons ligt (Gladysjev and Arkhipova, 2007)., Maar TERT is slechts één van de twee essentiële telomerasecomponenten, en TR is, in zijn oorsprong, nog raadselachtiger vanwege zijn lage opeenvolgingsbehoud in alle eukaryoten .
conclusie
aan het begin van het plantgenomicatijdperk werd de telomeersequentie als vrijwel onveranderlijk beschouwd. Het algemene behoud van telomeren en het telomerasesysteem suggereerden dat alle planten het tttaggg plant-type telomere kunnen hebben. De identificatie van ongebruikelijke telomeersequenties in complexe plantengenomen, in veel gevallen met gigantische C-waarden (zoals in Cestrum en Allium sp.,), was de moeite waard, omdat het uitzonderlijk lange Allium telomere motief de aanwijzing was bij het zoeken naar een echte TR in landplanten. De nieuw beschreven TR in planten en verder telomeer / telomerase onderzoek in basale clades van algen zou kunnen onthullen waardevolle informatie over vroege evolutie, daarom plant telomeer onderzoek kan aanzienlijk bijdragen aan hypothesen over de opkomst van eukaryoten.
Auteursbijdragen
VP en SG hebben in gelijke mate bijgedragen aan het schrijven, bewerken en voorbereiden van deze mini-review.,
financiering
belangenconflict
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die als een potentieel belangenconflict kunnen worden opgevat.
bevestigingen
One Thousand Plant Transcriptomes Initiative (2019). Duizend plantentranscriptomen en de fylogenomica van groene planten. Natuur 574 (7780), 679-685. doi: 10.1038 / s41586-019-1693-2
PubMed Abstract | CrossRef Full Text / Google Scholar
