voorbeeld-het voorspellen van moleculaire polariteit:
bepaal of de moleculen vertegenwoordigd door de volgende formules polair of onpolair zijn. (Het kan nodig zijn om Lewis structuren en geometrische schetsen te tekenen naar doso.)
a. CO2 B. OF2 c. CCl4 d. CH2Cl2 e. HCN
oplossing:
A. De Lewis-structuur voor CO2 is
de elektronegativiteit van carbon en oxygenare 2.55 en 3.44. De 0.,89 verschil in elektronegativiteit geeft aan dat de c-O-bindingen polair zijn, maar de symmetrische rangschikking van deze bindingen maakt het molecuul niet-polair.
als we pijlen in de geometrische schets voor CO2 plaatsen, zien we dat ze precies in evenwicht zijn, zowel in richting als in magnitude. Dit toont de symmetrie van de bindingen.
b., De Lewis-structuur voor OF2 is
de elektronegativiteit van zuurstof en fluor,respectievelijk 3,44 en 3,98, levert een 0,54 verschil op dat ons ertoe brengt te voorspellen dat de o-F-bindingen polair zijn. De moleculaire geometrie van OF2 is gebogen. Een asymmetrische verdeling van polaire bindingen zou een polair molecuul produceren.
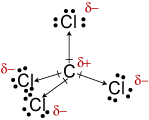
c. de moleculaire geometrie van CCl4 istetrahedral., Hoewel de C-Cl-bindingen polair zijn, maakt hun symmetrische rangschikking het molecuul niet-polair.
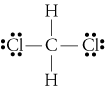
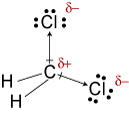
d. TheLewis structuur voor CH2Cl2 is
De electronegativities waterstof, koolstof, andchlorine 2,20, 2.55, en 3.16. Het 0,35 verschil in elektronegativiteit voor de H-C-bindingen vertelt ons dat ze in wezen niet-polair zijn. De 0.,61 het verschil in elektronegativiteit voor de C-Cl bindingen laat zien dat ze polair zijn. De volgende geometrische schetsen laten zien dat de polaire bindingen zijnymmetrisch gerangschikt, zodat het molecuul polair is. (Merk op dat de Lewisstructuur hierboven ten onrechte suggereert dat de bindingen symmetrisch zijn gerangschikt.Houd er rekening mee dat Lewis structuren vaak een valse indruk geven van de geometrie van de moleculen die ze vertegenwoordigen.)

e., De nieuwe structuur en geometrische schets voor HCN zijn dezelfde:
de elektronegativiteit van waterstof,koolstof en stikstof is 2,20, 2,55 en 3,04. Het 0,35 verschil inelektronegativiteit voor de H-C-Binding laat zien dat het in wezen niet-polair is. Het 0,49 verschil in elektronegativiteit voor de C-N binding vertelt ons dat het polair is.Moleculen met één polaire binding zijn altijd polair.