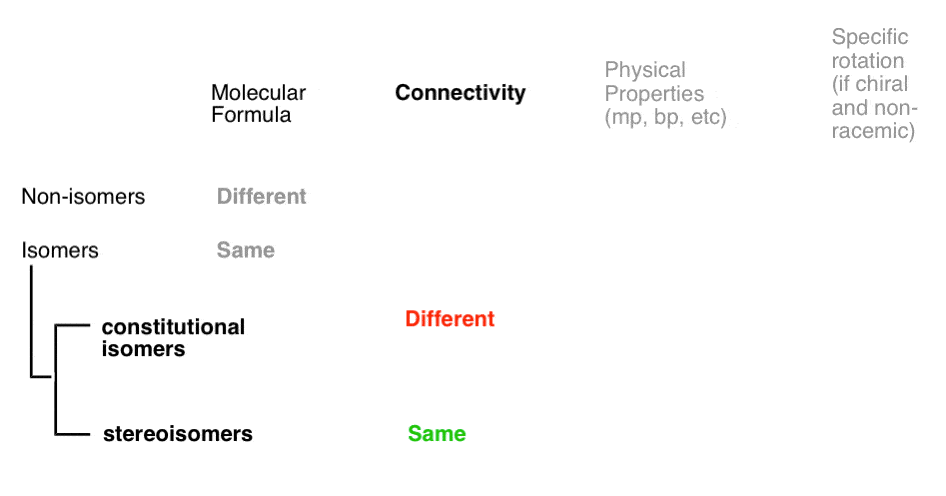
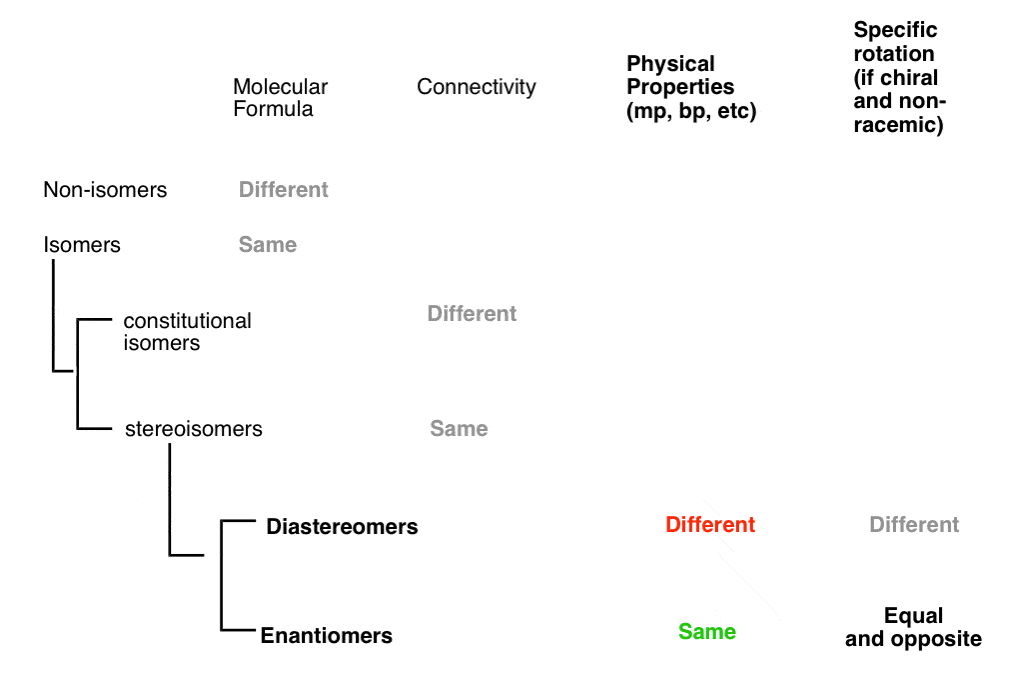
soorten isomeren: constitutionele isomeren, stereoisomeren, enantiomeren en diastereomeren
hoe weten we of moleculen “gerelateerd” zijn? En als we eenmaal weten dat ze dat zijn, hoe komen we erachter wat voor soort isomeer ze zijn?, Zijn ze constitutionele isomeren (dezelfde formule, verschillende connectiviteit), stereoisomeren (dezelfde connectiviteit, verschillende opstelling), enantiomeren (stereoisomeren die niet-superimposable spiegelbeelden zijn) of diastereomeren (stereoisomeren die niet niet-superimposable spiegelbeelden zijn.
of zijn ze hetzelfde? :- ) Antwoord op al deze vragen… en meer!
inhoudsopgave
- ” Hoe zijn we weer verwant?”- Hoe isomeren op familieleden lijken
- de soorten relaties tussen moleculen
- Hoe een paar niet-isomeren te onderscheiden vs., Een Paar Van Isomeren
- Soorten Isomeren: Constitutionele Isomeren verschillen Connectivites
- Soorten Isomeren: stereo-Isomeren Hebben Dezelfde Connectiviteit, Maar in Een Andere Rangschikking Van de Atomen In de Ruimte
- Stereogenic “Elementen” In stereo-Isomeren
- Soorten Isomeren: Enantiomeren vs. Niet-Enantiomeren (een.k.een. Diastereomers)
- Wat Betekent ‘Niet-Superimposable spiegelbeeld’ Zelfs Betekenen??,
- Eigenschap Broers Seizoen 13, Aflevering 13: “Heer Voldemort En De Eigendom Van Chiraliteit”
- Enantiomeren Hebben dezelfde Fysische Eigenschappen, Behalve voor Optische Rotatie
- “De Derde Eigenschap Broeder”: meso-Wijnsteenzuur
- Alleen Chirale Moleculen Kunnen Hebben Enantiomeren
- Diastereomers Zijn stereo-Isomeren Die Niet Enantiomeren
- Diastereomers Hebben Verschillende Fysische Eigenschappen
- Een Snelle Manier om Te Vertellen Als Twee stereo-Isomeren Zijn Diastereomers
- Kijk Uit Voor Truc Vragen!,
- samenvatting: soorten isomeren
- opmerkingen
” hoe zijn we weer verwant?”- Hoe isomeren zijn als familieleden
een paar weken geleden, op een familiereünie in Ontario, introduceerde ik mijn familieleden aan de vreugde van vloeibaar stikstofijs. Mijn neven en nichten waren er, net als veel van hun kinderen. Net als een paar neven van mijn vaders. Als familiereünie nodigden ze hun (volwassen) kinderen uit, die op hun beurt hun kinderen meebrachten. Terwijl ik hun ijs serveerde, vroeg ik me in de Nevel van de damp van de vloeibare stikstof af: “zijn dit mijn achterneven? Of mijn achterneef ooit verwijderd…?,”
shit, vergeet ik. Hoe werkt dat neef ding ook alweer?
in de organische chemie, kunnen we onszelf ook puzzelen over vragen als,”hoe zijn deze twee (of meer) moleculen gerelateerd”? En net als familie terminologie, het onthouden van het onderscheid tussen constitutionele isomeren, stereoisomeren, enantiomeren, en dergelijke kan een strijd op het eerste.
In dit bericht proberen we te laten zien hoe we vragen kunnen beantwoorden als:
- zijn deze twee moleculen isomeren? (en wat zijn isomeren eigenlijk?,)
- zijn deze twee isomeren constitutionele isomeren of stereoisomeren (en wat is het verschil?)
- zijn deze twee stereoisomeren enantiomeren of diastereomeren (en wat betekent dat?)
gelukkig is het antwoord op elk van deze vragen heel duidelijk, en ik hoop dat je zult merken dat met oefening (en een paar levendige voorbeelden) gemakkelijker te onthouden zijn dan het hele achterneef-versus achterneef-eenmaal verwijderd ding.,
de soorten relaties tussen moleculen
een molecuul kan meerdere types isomeer tegelijkertijd zijn, afhankelijk van met welke molecule je het vergelijkt.
om onze familie-analogie te gebruiken: de termen “broer”, “zus”, “moeder”, “dochter” zijn woorden die relaties beschrijven tussen (ten minste) twee mensen. U kunt een dochter (voor uw moeder), een zus (voor uw broer), een neef (voor uw tante & ooms’ kinderen), en “niet verwant” (voor mij) allemaal tegelijk.,
vragen of u een dochter of een zus bent heeft geen zin zonder de context van het opnemen van de persoon “met wie” u die relatie deelt.
zo is het met moleculen. Een molecuul kan constitutioneel isomeer, diastereomeer, enantiomeer, en meer zijn (of geen!), allemaal tegelijk met verschillende moleculen, afhankelijk van met welke andere molecule (s) je het vergelijkt.
er zijn drie belangrijke onderscheidingen om te leren, en we zullen ze elk op hun beurt doornemen.,
- een gegeven paar moleculen kan isomeren of niet-isomeren
- een gegeven paar isomeren kan constitutionele isomeren of stereoisomeren
- een gegeven paar stereoisomeren kan enantiomeren of diastereomeren
zijn (vooral bij onderzoeken is er altijd de mogelijkheid dat een “gegeven paar moleculen” eigenlijk hetzelfde molecuul is, anders getekend. We zullen die mogelijkheid te dekken).,
Het stroomdiagram geeft als volgt weer:
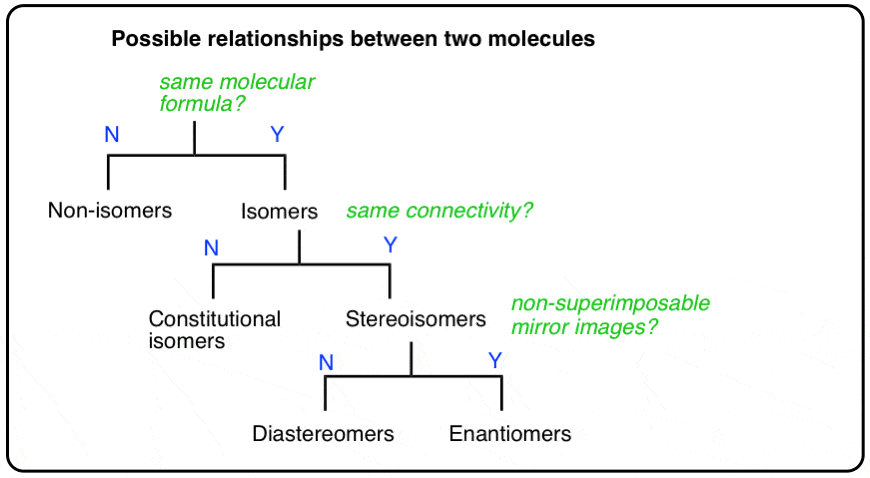
een belangrijk verschil tussen families en moleculen:
door omstandigheden laat ik het aan de lezer over om erachter te komen, is het mogelijk dat iemand tegelijkertijd zowel een vader als een broer is voor hetzelfde individu.
gelukkig hebben we zulke problemen niet in de organische chemie.
twee moleculen kunnen stereoisomeren van elkaar zijn, maar het kunnen geen stereoisomeren en constitutionele isomeren van elkaar zijn. Het onderscheid is duidelijk.
Hoe onderscheid je een paar niet-isomeren vs., Een paar isomeren
isomeren zijn twee (of meer) moleculen met dezelfde Molecuulformule.
voor sommige moleculaire formules bestaan er geen isomeren. Bijvoorbeeld, er is slechts één mogelijke isomeer voor CH4( methaan), C2H6 (ethaan) en propaan (C3H8), en slechts twee zijn mogelijk voor C4H10 (2-methylpropaan en n-butaan).
naarmate het aantal koolstofatomen toeneemt, neemt echter ook het aantal mogelijke isomeren toe. Voor dodecaan (C12H26) zijn 355 isomeren mogelijk. En vanaf daar gaat het omhoog!,
hoewel isomeren dezelfde moleculaire formules delen, kunnen zij zeer verschillende fysische eigenschappen hebben, zoals kookpunt, smeltpunt en chemische reactiviteit.
neem cyclohexaan (b.P. 63 °C) en 1-hexeen (80 °C) die beide de molecuulformule C6H12 hebben. Het maakt niet uit hoe verschillend hun fysische eigenschappen, of reactiviteiten, hun gemeenschappelijke moleculaire formule maakt ze isomeren van elkaar.,
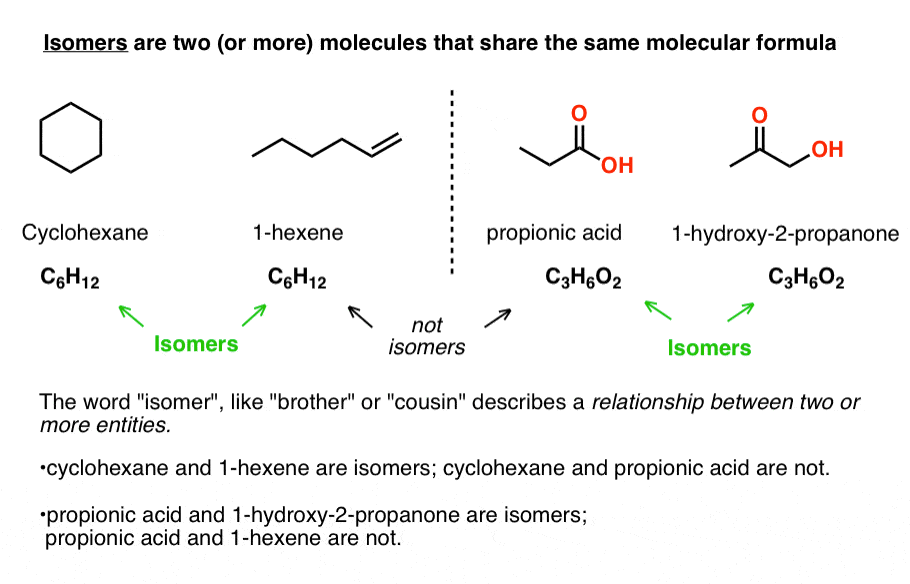
evenzo delen propionzuur en 1-hydroxy-2-propanon dezelfde moleculaire formule, C3H6O2, waardoor ze isomeren van elkaar zijn (maar natuurlijk geen isomeren van cyclohexaan of 1-hexeen!).

Dit leidt ons naar de volgende vraag. Laten we zeggen dat twee gegeven moleculen isomeren zijn. Wat voor isomeer zijn ze?
isomeren verdelen zich netjes in twee categorieën: constitutionele isomeren (verschillende connectiviteit) en stereoisomeren (dezelfde connectiviteit, verschillende indeling in de ruimte). Wat betekent dat eigenlijk?
4., Soorten isomeren: constitutionele isomeren hebben verschillende Connectivieten
constitutionele isomeren hebben dezelfde moleculaire formule, maar verschillende connectiviteit.
dezelfde delen, maar op verschillende manieren gerangschikt. Om dit oude voorbeeld te nemen, wissel een staart en een been en je maakt isocats:

dat is leuk, maar is er een meer rigoureuze manier om na te denken over connectiviteit?
Ik vind de volgende vuistregel nuttig:
constitutionele isomeren hebben dezelfde empirische formules, maar hun core IUPAC namen zijn verschillend.,
bij wijze van voorbeeld zijn deze 5 moleculen allemaal constitutionele isomeren van elkaar. Ze hebben dezelfde empirische formule (C6H12) maar verschillende connectiviteit. Merk op hoe de IUPAC namen zijn allemaal compleet verschillend ook.
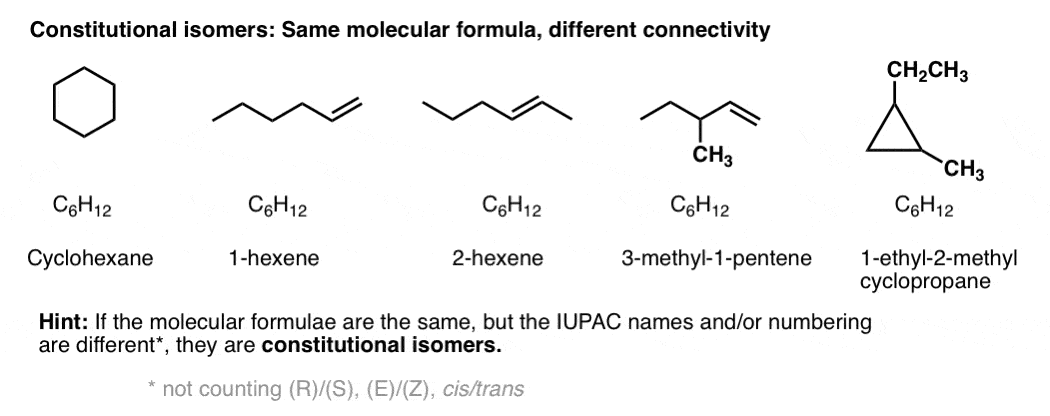
typen isomeren: stereoisomeren hebben dezelfde connectiviteit, maar een andere rangschikking van hun atomen in de ruimte
Er is maar één manier om C6H12 aan elkaar te verbinden om cyclohexaan te vormen, en slechts één manier om dezelfde atomen aan elkaar te verbinden om 1-hexeen te krijgen.,
maar er zijn twee manieren om C6H12 te verbinden om moleculen te geven met de namen 2-hexeen, en 3-methyl-1-penteen! En vier manieren om C6H12 te verbinden om 1-ethyl-2-methylcyclopropaan te geven!
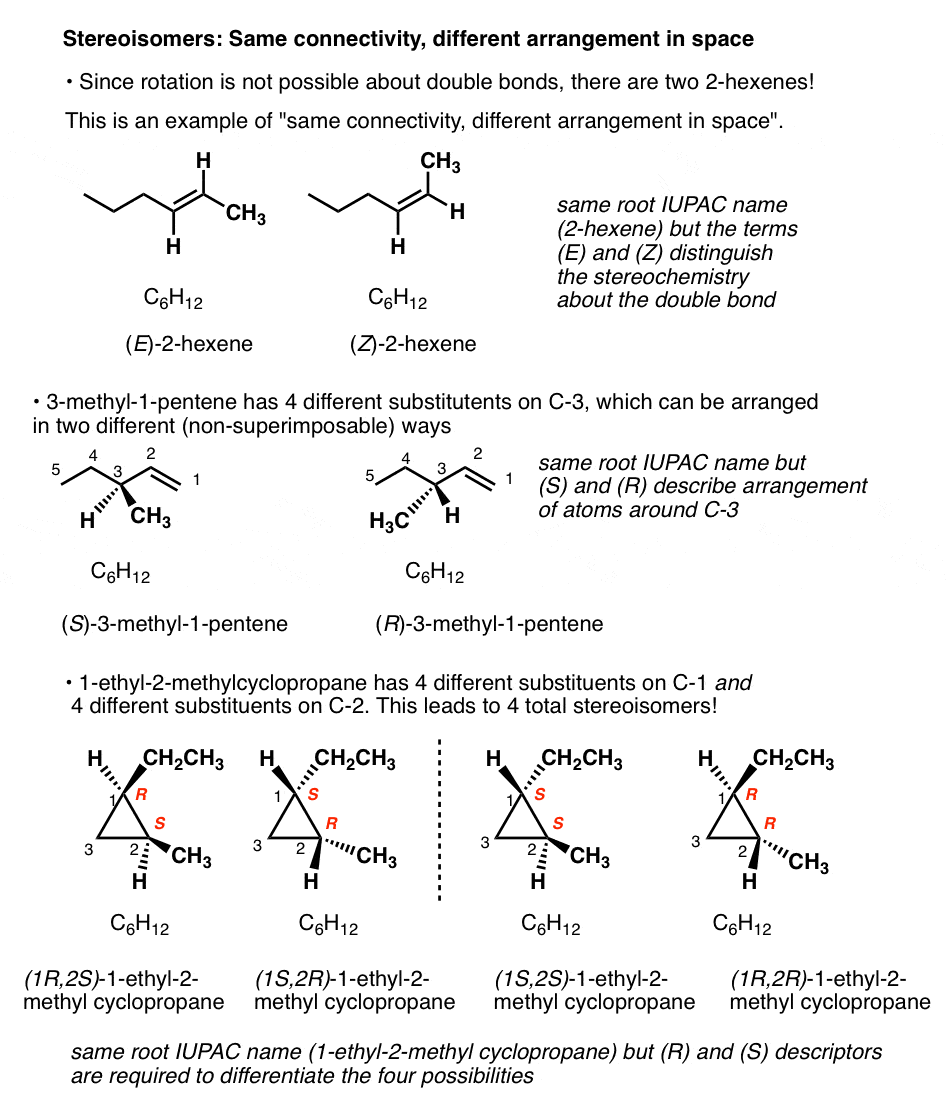
(snelle manier om een goed opgeleide organische chemicus te identificeren: vraag hen om 2-hexeen te tekenen, en meet hoe snel ze nodig hebben om “welke”te zeggen?).
bijvoorbeeld: er zijn twee manieren om de waterstofatomen te rangschikken op de dubbele binding van 2-hexeen; als ze aan dezelfde kant staan, noemen we het cis (of Z); aan de andere kant trans (E). .,
omdat vrije rotatie over de dubbele binding niet mogelijk is, zijn dit volledig verschillende moleculen. Ze kunnen worden gescheiden, in verschillende kolven worden geplaatst, jarenlang op de plank worden gelaten, en nooit interconverteren. U kunt cis-2-hexeen (95%) van Aldrich kopen, laat het twee decennia in de opslagruimte en vrees nooit dat het in de Transvorm is veranderd.
wat voor soort isomeren zijn dit? We kunnen ze geen constitutioneel isomeer noemen, omdat ze dezelfde connectiviteit hebben (beide zijn 2-hexeen! ). We hebben een andere naam nodig., Omdat ze verschillen in de rangschikking van hun groepen in de ruimte over de dubbele binding noemen we ze stereo-isomeren.
stereoisomeren kunnen ook ontstaan uit tetraëdrische koolstofatomen die aan vier verschillende substituenten (d.w.z. een “chirale” of “asymmetrische” koolstof) zijn bevestigd, zoals in 3-methyl-1-penteen. Er zijn er 2 (en slechts 2!) verschillende manieren om vier verschillende groepen rond een tetraëdrisch Centrum te rangschikken, wat leidt tot twee moleculen die dezelfde connectiviteit delen maar verschillen in de rangschikking van hun atomen in de ruimte., Deze moleculen kunnen er hetzelfde uitzien, maar ze zijn eigenlijk niet-superimposable spiegelbeelden (meer daarover een paar alinea ‘ s hieronder).
Stereogene “elementen” in stereoisomeren
een dubbele binding die geschikt is voor cis/trans-isomerisme en een “asymmetrisch” koolstofatoom worden soms “stereogene elementen” genoemd, omdat zij elk een paar stereoisomeren (E of Z), of (R of S)
- een molecuul met 2 stereoisomeren kan leiden tot (2 × 2) = 4 verschillende stereoisomeren. Dit is het geval met 1-ethyl-2-methylcyclopropaan: (R,R), (S,S), (R,S) en (S, R).,
- een molecuul met 3 stereogene elementen kan leiden tot zo veel als (2 × 2 × 2) = 8 verschillende stereoisomeren.
- in het algemeen kan een molecuul met n stereogene elementen tot 2n stereoisomeren hebben. (Waarschijnlijk het gekste bekende voorbeeld in de chemie is palytoxine, die 64 chirale centra, 8 dubbele bindingen, en ongeveer 1021 mogelijke stereoisomeren heeft. )
een snelle manier om te zien of twee moleculen stereoisomeren zijn is als ze dezelfde kern IUPAC-naam hebben, maar verschillen in hun cis/trans, E/Z, of (R)/(S) benamingen.
7., Soorten stereoisomeren: enantiomeren VS.niet-enantiomeren (ook wel diastereomeren genoemd)
We zijn nog niet helemaal klaar. Er is een laatste belangrijk onderscheid te maken tussen twee verschillende soorten stereoisomeren.
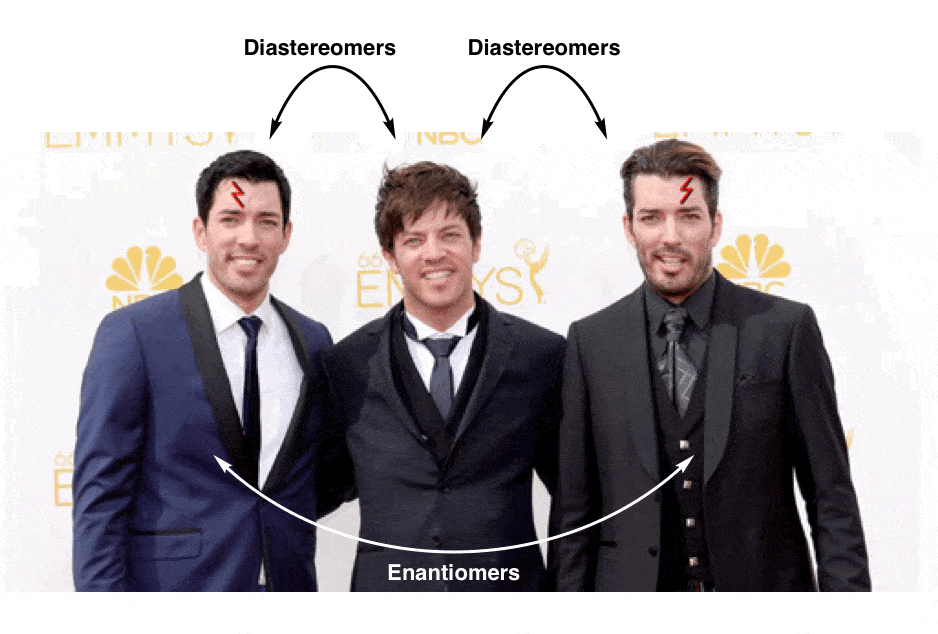
waarom?, Goed, om onze familie analogie net een beetje verder… laten we praten over broers:

(ja, er is een derde Eigendom van Brother)
Deze drie mannen zijn allemaal broeders zijn, maar het is duidelijk dat er iets speciaals aan de relatie tussen twee van de drie die verdiensten zijn eigen categorie:
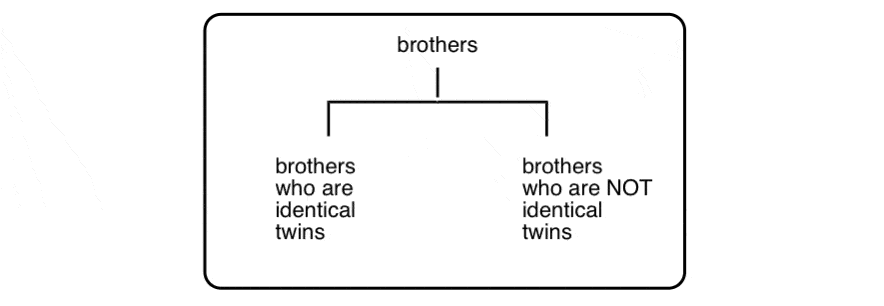
Dit is niet in tegenstelling tot het onderscheid tussen diastereomers (stereo-isomeren die NIET niet-superimposable spiegel beelden) en enantiomeren (stereo-isomeren, die niet-superimposable spiegelbeeld).,
wat betekent” niet-Superimposable Mirror Image”??
Ik geef toe: de term “niet-superimposable mirror images” lijkt mensen net zoveel problemen te geven als het “achterneef versus eenmaal verwijderd” ding. Laten we dit nu bespreken.in onze familie analogie (hierboven) maakten we ” broers die eeneiige tweeling zijn “analoog aan enantiomeren, en” broers die geen eeneiige tweeling zijn ” analoog aan diastereomeren.
We moeten deze analogie een beetje aanpassen.
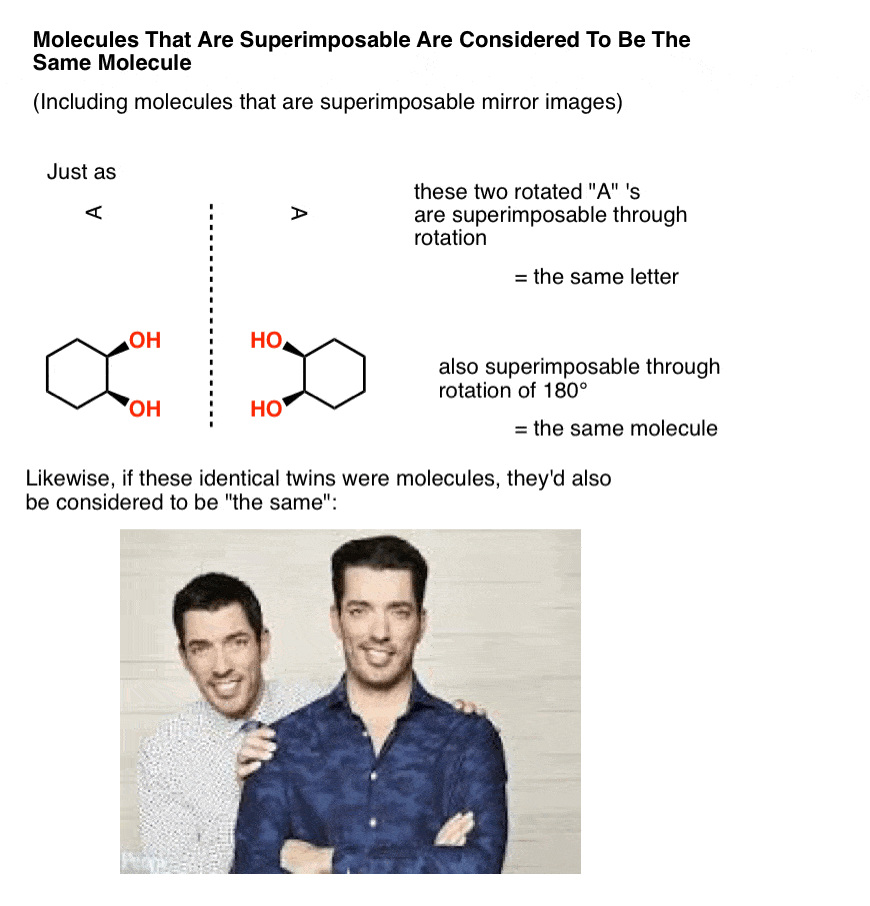
in de organische chemie kunnen twee moleculen op elkaar worden gelegd, door rotatie van bindingen (d.w.z., conformational veranderingen) of door rotatie van de molecule zelf, worden beschouwd om dezelfde molecule te zijn.
met andere woorden, in de organische chemie zijn moleculen die “identieke tweelingen” zijn geen isomeren; zij worden beschouwd als identieke kopieën van hetzelfde molecuul.
een mol is immers 6,02 × 1023 identieke, over elkaar heen grijpende moleculen., En net als identieke tweelingen zijn nog steeds identiek als een zit aan een bureau op zoek naar beschikbare onroerend goed dat is in uw prijsklasse, terwijl de andere staat in een waardeloze keuken gebaren met zijn handen proberen om u te laten zien hoe het volledig kan worden gerenoveerd om uw budget passen, moleculen worden nog steeds beschouwd als “identiek” als ze toevallig in verschillende conformatie, zolang ze elk passeren ten minste een conformatie waarin ze zijn superponeerbaar.,
laten we nu een kleine wijziging aanbrengen aan onze identieke tweelingen zodat ze van superimposable mirror images (= hetzelfde) gaan naar niet-superimposable mirror images.Property Brothers seizoen 13, Aflevering 13: “Lord Voldemort And The Property of Chirality”
verteller: onze cliënt, “Lord Voldemort” zei dat hij op zoek was naar een nieuw boosaardig hol met “good bones”, dus namen we hem mee in de stad om te kijken naar een aantal eigenschappen die passen bij zijn lijst van “must haves” en budget. Later die avond, na een paar drankjes, werd het ongemakkelijk.,
LORD VOLDEMORT: Hey jongens, Ik heb eigenlijk een nieuwe eigenschap die je misschien interessant vindt
DREW en JON: Jesus! Wat is die dunne –
LV: de eigenschap van chiraliteit! Racemundum suorum!
ZAP! (lichtflits)
DREW en JON: Aaarrrggh!!
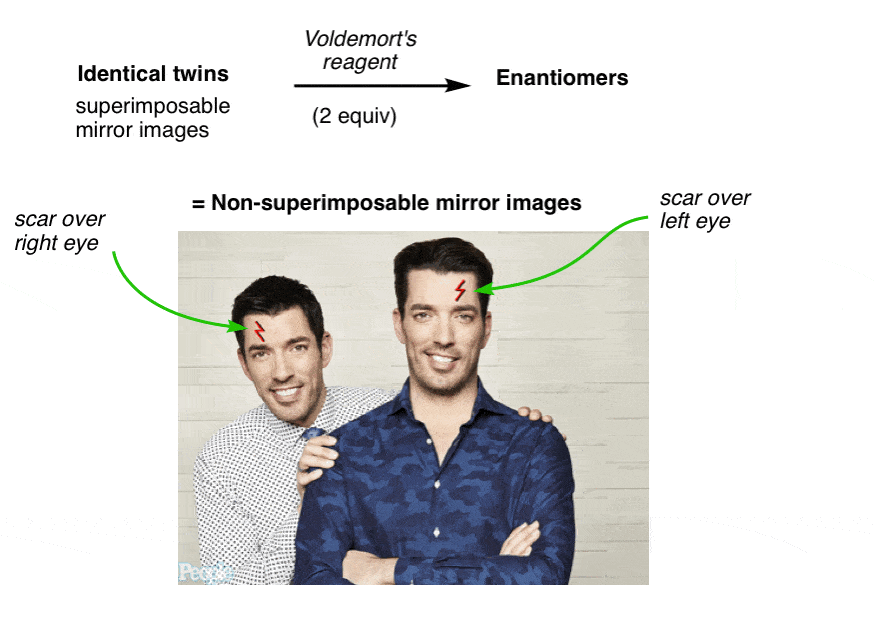
De ene heeft een litteken over zijn linkeroog en de andere heeft een litteken over zijn rechteroog. Geen enkele hoeveelheid draaien en draaien op de vloer in pijn kan mogelijk maken ze nu superponeerbaar.
ze zijn “enantiomers” geworden: niet-superimposeerbare spiegelbeelden.,
omdat ze niet langer superponeerbaar zijn, zijn ze in scheikundige termen niet meer hetzelfde. Vergelijkbaar, Ja! Maar niet hetzelfde molecuul.
Wat is er veranderd?
Voldemort ’s reagens
voordat we Voldemort’ s reagens toevoegden, had elke tweeling een vlak van symmetrie langs het midden van zijn lichaam, zodat de linker-en rechterhelft identiek waren. Niet meer. Nu is de linkerhelft van elke tweeling anders dan de rechterhelft. We noemen deze eigenschap “asymmetrie”, of “chiraliteit”.
de introductie van het litteken “brak de symmetrie” van elke tweeling en introduceerde chiraliteit.,

met moleculen is de meest voorkomende manier om chiraliteit te geven met een koolstofhoudende 4 verschillende groepen, zoals in 4-methyl-1-penteen hierboven. Om deze reden wordt een koolstof aan 4 verschillende groepen een chiraal centrum, of “asymmetrisch centrum” genoemd.
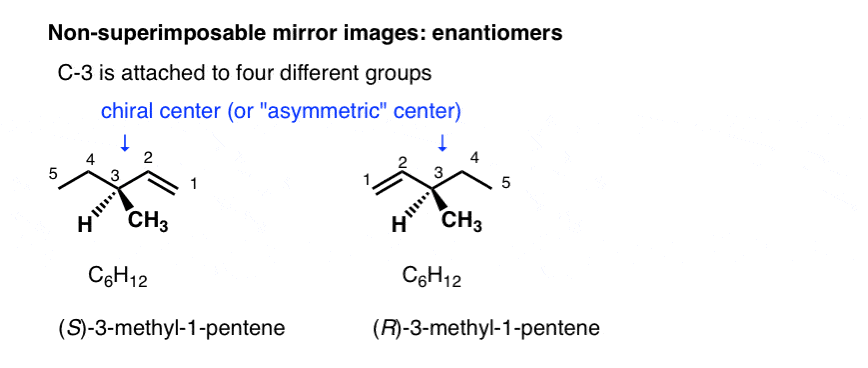
Er zijn twee (en slechts twee!) manieren om 4 verschillende substituenten rond een tetraëdrische koolstof te rangschikken. Dus een molecuul met een enkel asymmetrisch centrum zal bestaan als een paar stereoisomeren., Om specifieker te zijn, zal het bestaan als een paar niet-superimposable spiegelbeelden: enantiomers.
enantiomeren hebben identieke fysische eigenschappen behalve optische rotatie
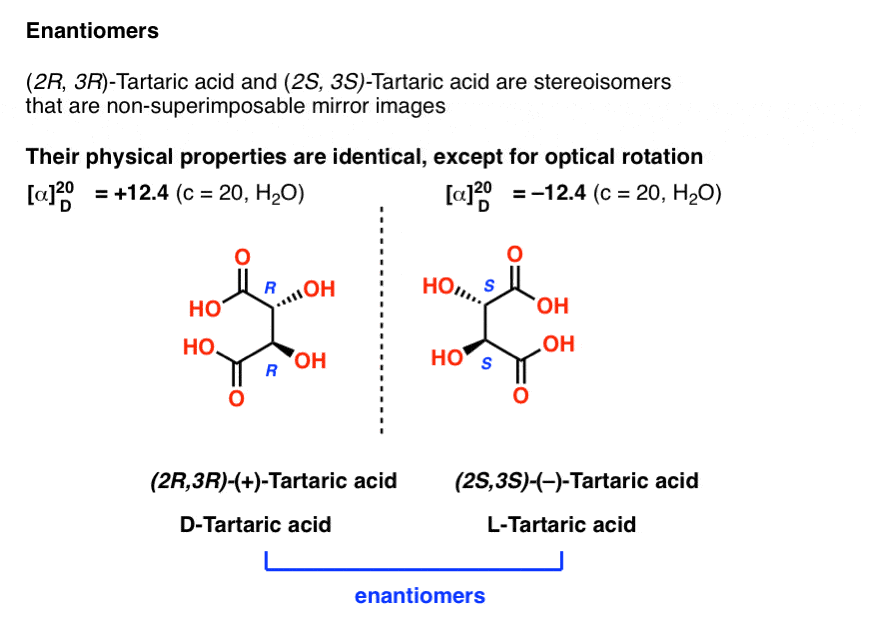
eerder beschreven we Louis Pasteur ‘ s avonturen met wijnsteenzuur waar hij ontdekte dat een verbinding die toen bekend stond als “racemic acid” (van het Latijnse racemus = “een tros druiven”) in feite een gelijk mengsel was van twee spiegelbeeld vormen van wijnsteenzuur.
Het scheiden van deze twee isomeren was hell on wheels, omdat ze identieke oplosbaarheden, smeltpunten en andere fysische eigenschappen hebben., Pasteur was alleen in staat om het te bereiken door het observeren van minuscule verschillen in het uiterlijk van hun zouten, en pakte ze uit elkaar met behulp van een pincet en een vergrootglas.
de enige fysische eigenschap die deze twee isomeren onderscheidt is dat ze het vlak van gepolariseerd licht in gelijke en tegengestelde richtingen draaien.
achteraf gezien weten we nu dat de structuren van deze twee isomeren van wijnsteenzuur, en met behulp van de Cahn-Ingold-Prelog regels, ze (R, R) en (S,S) wijnsteenzuur hebben genoemd.
deze twee isomeren zijn spiegelbeelden van elkaar: niet-superimposable spiegelbeelden.,
net als bij de plaatsing van Voldemort ‘ s littekens, kan geen enkele hoeveelheid bindrotatie een (R) configuratie veranderen in een (S) Configuratie, of omgekeerd.
Dit is een belangrijke aanwijzing voor het identificeren van enantiomeren (en een die we verder zullen bespreken in een toekomstig bericht):
enantiomeren zullen altijd dezelfde IUPAC-namen hebben, en volledig tegenovergestelde (R/S) descriptoren.,
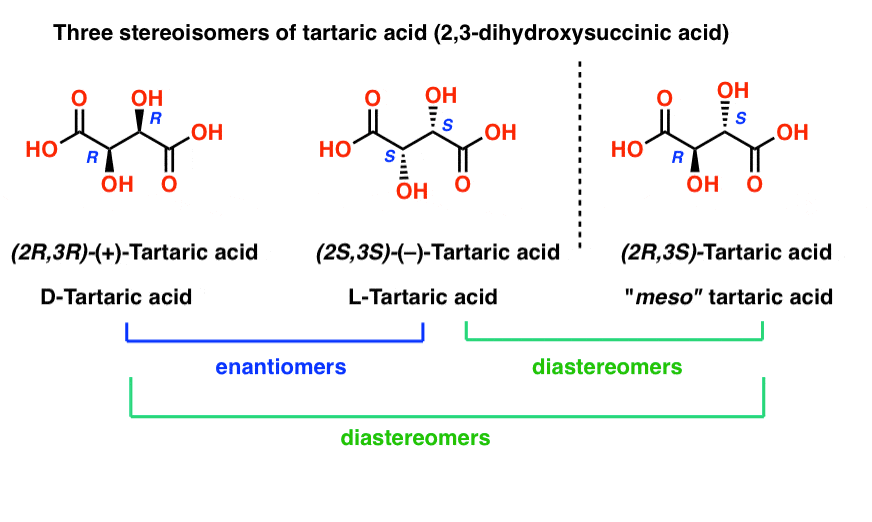
” de derde eigenschap Brother”: meso-wijnsteenzuur
wijnsteenzuur heeft twee asymmetrische koolstofcentra, en we zeiden eerder dat een molecuul met twee asymmetrische centra tot 22 = 4 stereoisomeren kan hebben. Als (2S, 3S) en (2R,3R) twee stereoisomeren van wijnsteenzuur zijn, hoe zit het dan met (2R, 3S) en (2S, 3R) wijnsteenzuur? Dit moeten ook stereoisomeren zijn, toch?
wanneer we de structuren van (2R,3S) en (2S,3R) wijnsteenzuur trekken, wordt echter al snel iets duidelijk.,
hoewel het inderdaad spiegelbeelden van elkaar zijn, zijn het spiegelbeelden van elkaar op dezelfde manier dat onze (pre-Voldemort) identieke tweelingen spiegelbeelden van elkaar zijn:
het zijn superponeerbare spiegelbeelden, en daarom beschouwd als identieke moleculen.
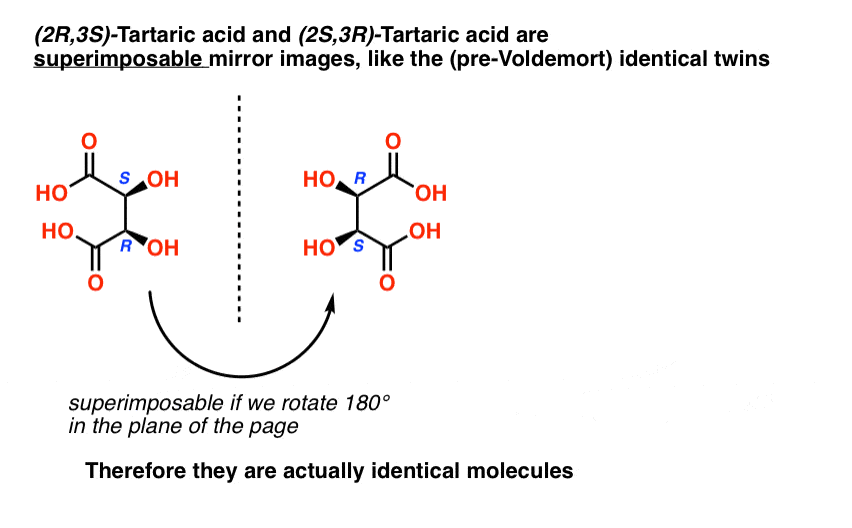
daarom zijn (2R, 3S)-wijnsteenzuur en (2S, 3R)-wijnsteenzuur geen enantiomeren. Het zijn eigenlijk twee verschillende manieren om hetzelfde molecuul te beschrijven, en wijnsteenzuur heeft in totaal slechts drie stereoisomeren.
wacht., Hoe kan het zijn dat een molecuul chirale centra kan hebben maar geen enantiomeer?
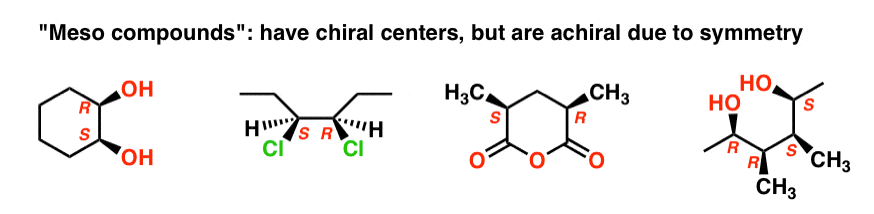
12. Alleen chirale moleculen kunnen enantiomeren
hebben op dezelfde manier als onze (pre-Voldemort) eigenschap broer (chirale) linker en rechter oren had, maar achiraal was over het algemeen toe te schrijven aan het interne spiegelvlak. Alleen chiral molecules kunnen enantiomers hebben.
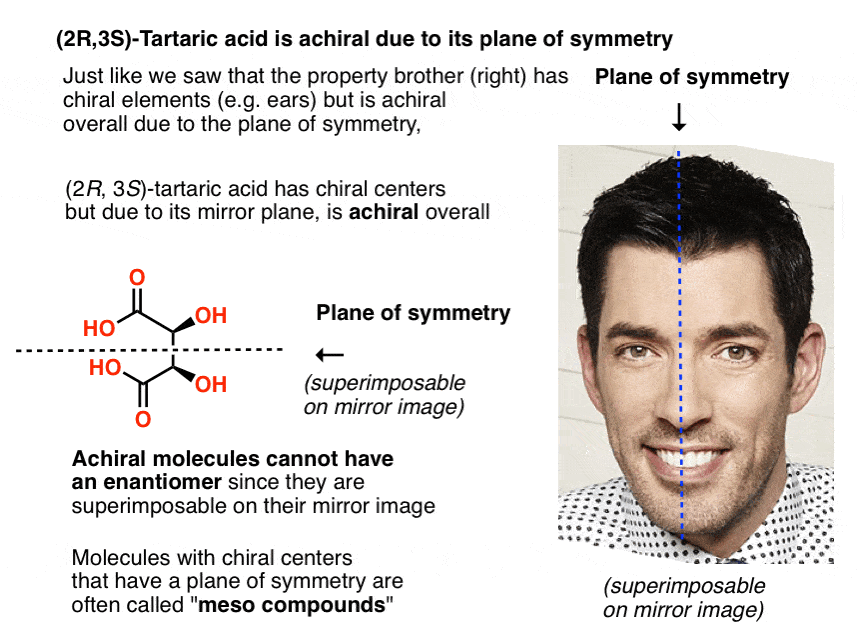
een molecuul met een inwendig spiegelvlak – een symmetrievlak – is achiraal en zal geen enantiomeer hebben.
evenzo heeft (2R, 3S)-wijnsteenzuur chirale centra, maar bezit een inwendig spiegelvlak., Het chiraal centrum met de S Configuratie is het spiegelbeeld van het chiraal centrum met de R configuratie, en de andere substituenten zijn symmetrisch gerangschikt.
Dit stereoisomeer van wijnsteenzuur was bekend bij Pasteur, omdat het gemakkelijk kon worden gescheiden van” racemisch ” wijnsteenzuur vanwege zijn verschillende fysische eigenschappen (oplosbaarheid). Aangezien de specifieke rotatie (0°) in het midden (meso = “midden” in het Grieks) tussen levo (–) en dextro (+) wijnsteenzuur lag, kreeg het de naam meso-wijnsteenzuur.,nu we weten wat we nu doen, is het logisch dat meso-wijnsteenzuur een specifieke rotatie van 0° heeft, omdat alleen chirale moleculen het vlak van gepolariseerd licht roteren, en Meso-wijnsteenzuur achiraal is.
de naam “meso” is meer algemeen aangenomen. Een “Meso-samenstelling” is een molecuul dat chirale centra heeft, maar achiral algemeen toe te schrijven aan de aanwezigheid van een intern spiegelvlak is.
daarom werd de kwalificatie” tot 22 stereoisomeren ” gebruikt., Een molecuul met 2 stereocenters kan “tot” 4 stereoisomeren hebben, maar kan minder dan 4 hebben als er een meso-vorm aanwezig is.
meso-wijnsteenzuur is een soort van de derde eigenschap broer: “degene die geen tweeling is”.
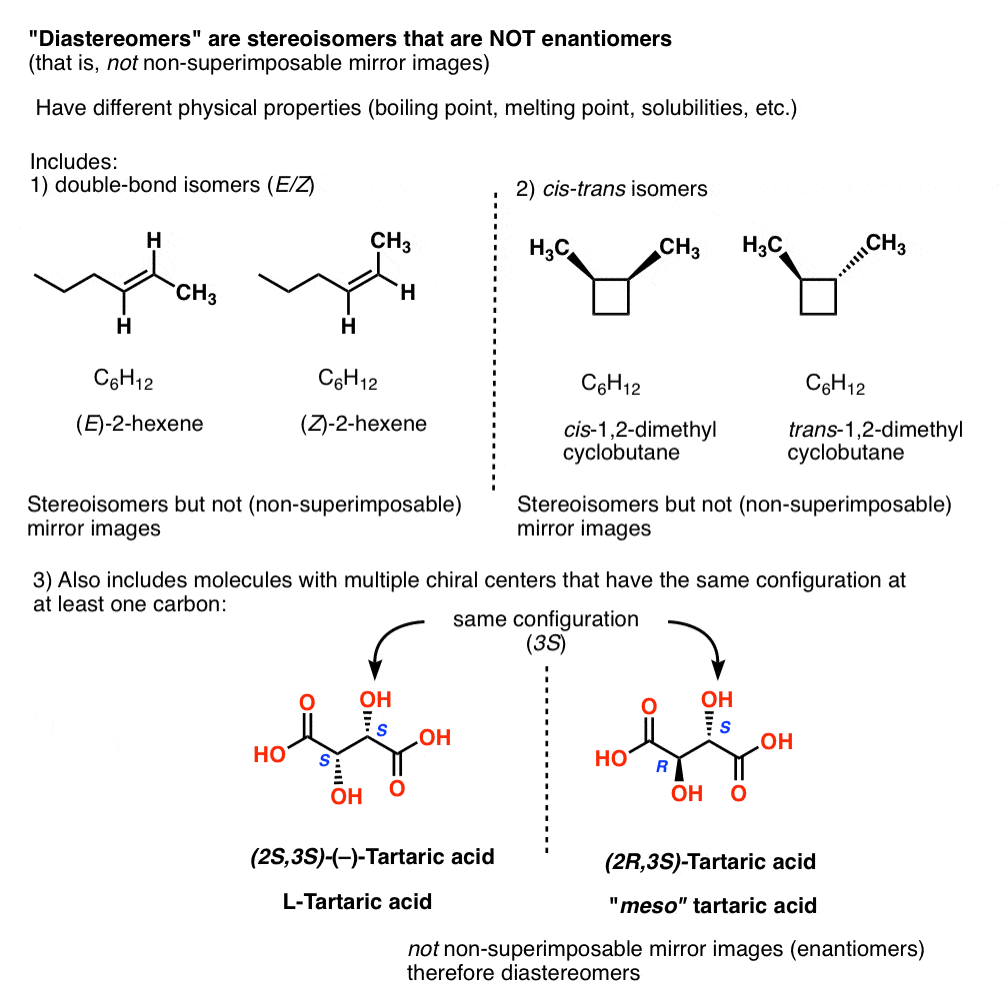
diastereomeren zijn stereoisomeren die geen enantiomeren zijn
dus als (2R, 3R) – wijnsteenzuur en (2S, 3S)-wijnsteenzuur enantiomeren zijn, hoe beschrijven we de relatie tussen elk van deze moleculen en meso-wijnsteenzuur?
in de organische chemie noemen we” stereoisomeren die geen enantiomeren zijn ” diastereomeren.,
meso-wijnsteenzuur is een diastereomer van beide (2R,3R)-wijnsteenzuur en (2S, 3S)-wijnsteenzuur:
Andere voorbeelden van “diastereomers” zijn:
- dubbele binding isomeren (E/Z)
- cis–trans-isomeren
- stereo-isomeren van moleculen met meerdere chirale centra die dezelfde configuratie op (ten minste) één koolstof
14., Diastereomeren hebben verschillende fysische eigenschappen
net zoals Pasteur meso-wijnsteenzuur relatief gemakkelijk kon scheiden van “racemisch”wijnsteenzuur, hebben diastereomeren verschillende fysische eigenschappen (bv. kookpunt, smeltpunt, oplosbaarheid, enz.).
15. Een snelle manier om te zien of twee stereoisomeren diastereomeren zijn
een snelle manier om te zien of twee stereoisomeren diastereomeren zijn:
- als twee stereoisomeren verschillen in cis/trans of E/Z descriptoren (bijv., cis-2-hexeen en trans-2-hexeen)
- als ze ten minste één identieke R/S-descriptor hebben (zoals in (2S,3S)-wijnsteenzuur en (2R, 3S) – wijnsteenzuur (als alle R/S-descriptoren hetzelfde zijn, moeten ze op de een of andere manier verschillen in cis/trans-of E/Z-oriëntatie om diastereomeren te zijn; anders zijn ze hetzelfde molecuul!)
16. Kijk Uit Voor Strikvragen!
laatste voorbeeld, Ik beloof het.
neem de twee onderstaande moleculen. Zijn het isomeren? Zo ja, wat voor isomeer zijn ze?,
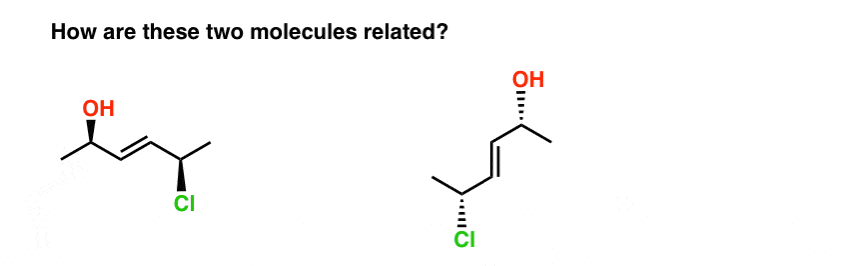
de snelste manier die ik ken om deze vraag te beantwoorden is door ze beiden een naam te geven.
wanneer we dit doen, vinden we dat:
- het molecuul links is E – (2R, 5R)-5-chloor-hex-3-een-2-ol
- het molecuul rechts is E-(2R, 5R)-5-chloor-hex-3-een-2-ol
dus hoe zijn ze gerelateerd?
- Het zijn geen constitutionele isomeren (dezelfde connectiviteit!)
- maar het zijn ook geen stereoisomeren (dezelfde E/Z en R / S descriptoren !)
daarom zijn ze hetzelfde!, (Eigenlijk zijn het verschillende vormen van hetzelfde molecuul, en we gaan ervan uit dat alle vormen van hetzelfde molecuul onderling veranderlijk zijn, tenzij anders gezegd. ) Zie voetnoot.
17. Samenvatting: typen isomeren
Dit was een lange, maar hopelijk uitgebreide en verhelderende post op de typen isomeren.
in de volgende aflevering zullen we een techniek leren die – met de praktijk – je in staat stelt om snel te bepalen of moleculen enantiomeren, diastereomeren of hetzelfde zijn.
nogmaals dank aan Matt voor co-authoring., Vraag Matt over het plannen van een online tutoring sessie hier.
noten
voetnoot-atropisomeren
over het algemeen nemen we aan dat conformationele isomeren snel interconverteren op de tijdschaal die nodig is om optische rotatie te meten.
de twee stoelformulieren van cis-1,2-dimethylcyclohexaan zijn bijvoorbeeld enantiomeren, maar omdat ze bij kamertemperatuur zo snel met elkaar in contact komen, worden ze behandeld alsof ze hetzelfde zijn.,
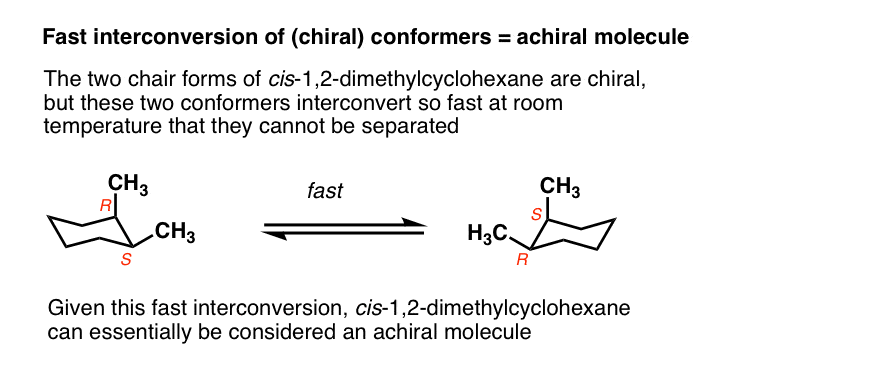
dit valt meestal buiten het bereik van de inleidende organische chemie, maar er zijn bepaalde gevallen waarin deze aanname niet geldig is.
een prominent voorbeeld is 1,1-bi-2-naftol (ook bekend als BINOL).
Conformer a (uiterst links) kan niet converteren naar conformer B (uiterst rechts) zonder door een conformatie te gaan waar de twee ringen coplanair (Midden) zijn , en de twee waterstofatomen op elke koolstof (koolstof 8) tegen elkaar botsen., Dit is een groot genoeg barrière voor rotatie dat elk van deze twee conformatie ‘gevangen’ is in zijn eigen staat bij kamertemperatuur en niet interconverteren.
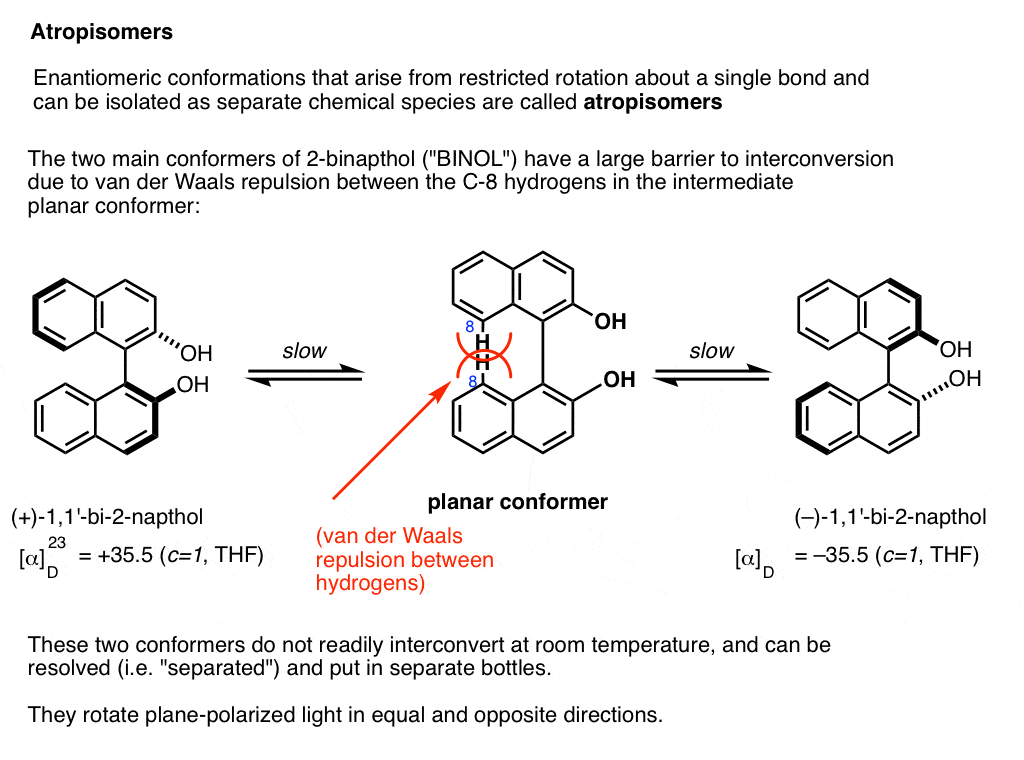
Deze twee conformaties zijn niet-superimposeerbare spiegelbeelden van elkaar op dezelfde manier als een linkshandige en rechtshandige schroef niet-superimposeerbare spiegelbeelden van elkaar zijn. Er wordt gezegd dat ze een “as van chiraliteit”hebben.
de barrière tussen de twee conformers is groot genoeg dat conformer A en conformer B kunnen worden opgelost (gescheiden) en in verschillende flessen kunnen worden geplaatst.,
Dit speciale geval van isoleerbare conformers wordt “atropisomerisme”genoemd.
