Przewidywanie mechanizmów SN1 vs SN2
rozważając, czy substytucja nukleofilowa może nastąpić za pośrednictwem mechanizmu SN1 lub SN2, naprawdę musimy wziąć pod uwagę trzy czynniki:
1) elektrofil: gdy grupa opuszczająca jest przyłączona do grupy metylowej lub węgla pierwotnego, mechanizm SN2 jest preferowane (tutaj Elektrofil jest niezakłócony przez otoczone grupy, a każdy carbocation intermediate byłby wysokoenergetyczny, a więc mało prawdopodobny)., Kiedy grupa odchodząca jest przyłączona do węgla trzeciorzędowego, allilowego lub benzylowego, półprodukt karbokacyjny będzie stosunkowo stabilny, a zatem preferowany jest mechanizm SN1. Te wzorce reaktywności podsumowano poniżej.,struktura halogenku ylu
2) nukleofile: potężne nukleofile, zwłaszcza te z ujemnymi ładunkami, sprzyjają mechanizmowi SN2., Słabsze nukleofile, takie jak woda czy alkohole, sprzyjają mechanizmowi SN1.
3) rozpuszczalnik: Polarne rozpuszczalniki aprotyczne sprzyjają mechanizmowi SN2 poprzez zwiększenie reaktywności nukleofila. Prototypy polarne sprzyjają mechanizmowi SN1 poprzez stabilizację stanu przejściowego i carbocation intermediate. Reakcje SN1 nazywane są reakcjami solvolizy, gdy rozpuszczalnikiem jest nukleofil.
te wzorce reaktywności są podsumowane w poniższej tabeli.,>
For example, the reaction below has a tertiary alkyl bromide as the electrophile, a weak nucleophile, and a polar protic solvent (we’ll assume that methanol is the solvent)., W ten sposób pewnie przewidzielibyśmy mechanizm reakcji SN1. Ponieważ substytucja zachodzi w chiralnym węglu, możemy również przewidzieć, że reakcja będzie przebiegać z racemizacją.

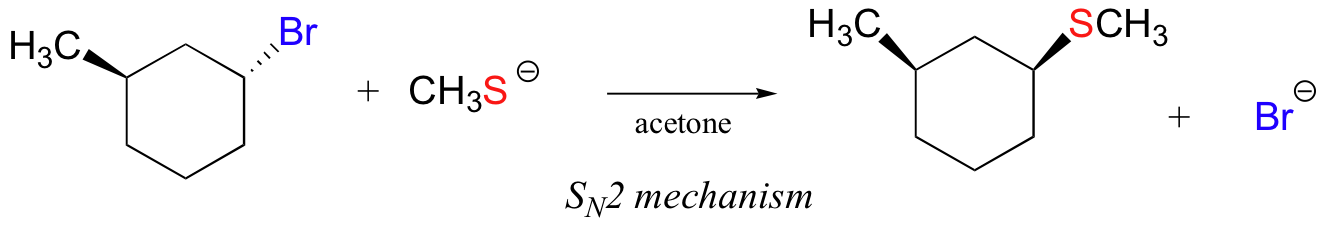
w poniższej reakcji elektrofil jest wtórnym bromkiem alkilowym – dzięki nim możliwe są zarówno mechanizmy SN1, jak i SN2, w zależności od nukleofilu i rozpuszczalnika. W tym przykładzie nukleofil (anion tiolanowy) jest silny i stosuje się polarny rozpuszczalnik protowy – tak więc mechanizm SN2 jest mocno faworyzowany., Oczekuje się, że reakcja będzie kontynuowana z inwersją konfiguracji.
ćwiczenia
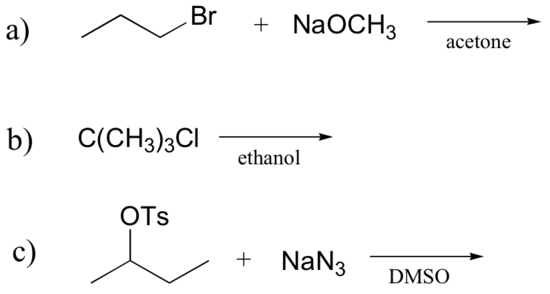
1. Określ, czy każda reakcja substytucyjna przedstawiona poniżej może przebiegać za pomocą mechanizmu SN1 lub SN2 i wyjaśnij swoje rozumowanie.
odpowiedź
A) SN2 B/C pierwszorzędowy halogenek alkilowy z silnym nukleofilem w polarnym rozpuszczalniku aprotowym.
b) SN1 B / C trzeciorzędowy halogenek alkilowy ze słabym nukleofilem, który jest również rozpuszczalnikiem (solvoliza).,
c) SN2 B / C drugorzędowe halogenki alkilowe sprzyjają temu mechanizmowi w reakcji z silnym nukleofilem (i słabą zasadą) w polarnym rozpuszczalniku aprotycznym.
