Stickstofftrifluorid Chemische Eigenschaften, Verwendungen, Produktion
Beschreibung
Stickstofftrifluorid ist ein farbloses Gas mit wenig Geruch. Stickstofftrifluorid ist ein Oxidationsmittel, das danndynamisch stabil ist, außer bei erhöhten Temperaturen. Bei Temperaturen bis etwa 250°C ist seine Reaktivität mit Sauerstoff vergleichbar. Bei höheren Temperaturen ähnelt seine Reaktivität Fluor aufgrund einer merklichen Dissoziation in NF2 und F-., Die thennale Dissoziation von Stickstofftrifluorid wurde von einer Reihe von Forschern untersucht und erreichte einen Höchstwert im Temperaturbereich von 1100K bis 1500K. Im Umgang mit Stickstofftrifluorid sollten Bedingungen vermieden werden, die zu hohen Temperaturen wie adiabatischer Kompression durch die schnelle Druckbeaufschlagung eines Systems führen können.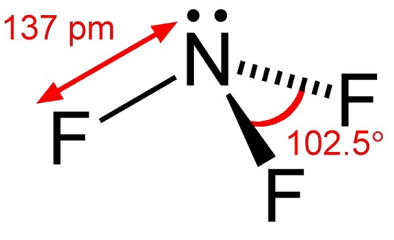
Stickstofftrifluorid wirkt primär auf die Elemente als Fluorierungsmittel, bei niedrigeren Temperaturen jedoch nicht sehr aktiv., Bei erhöhten Temperaturen pyrolysiert Stickstofftrifluorid mit vielen Elementen, um Stickstofftetrafluorid und das entsprechende Fluorid zu erzeugen. Die Pyrolyse von Stickstofftrifluorid über Kupferturnings erzeugt Stickstofftetrafluorid in einer Ausbeute von 62 Prozent bis 71 Prozent bei 707°F (375°C). Die Pyrolyse über Kohlenstoff ist vollständiger.
Chemische Eigenschaften
stickstofftrifluorid ist ein farbloses gas. Moldyodor. Versand als nicht verflüssigtes Druckgas.
Physikalische Eigenschaften
Farbloses Gas; schimmeliger Geruch; verflüssigt sich bei -128.75°C; Dichte der Flüssigkeit 3.,116 g/mL; Dampfdruck bei -158°C 96 torr; erstarrt bei -206.8°C; kritische Temperatur -39.15°C, Kritischer Druck 44.02 atm; kritisches Volumen 126 cm3/mol; sehr leicht löslich in Wasser.
Verwendet
Stickstofftrifluorid ist ein Ätzmittel und Kammerreinigungsmittel.
Oxidationsmittel für energiereiche Brennstoffe, chemische Synthese.
Verwendet
Stickstofftrifluorid ist ein Gas, das aus Stickstoff-und Fluoratomen besteht., Die globale Elektronikindustrie verwendet Stickstofftrifluorid in ihren Reinigungsprozessen, da das Gas andere Alternativen übertrifft, einfacher und sicherer zu handhaben ist und zur Reduzierung der Treibhausgasemissionen beiträgt.
Hersteller von Halbleitern, Dünnschicht-Solarzellen und Flachbildschirmen reinigen Prozesskammern mit Stickstofftrifluorid. Innerhalb der Kammern werden dünne Schichten aus Halbleiter – und Isolierfolien auf Wafer und Paneele aufgebracht., Stickstofftrifluorid entfernt die Rückstände, die diese Filme an den Kammerwänden hinterlassen, so dass die Kammern effizient arbeiten und ein Qualitätsgerät herstellen können.
Stickstofftrifluorid bietet viele Vorteile gegenüber alternativen Reinigungsmitteln. Es ist stabil bei Raumtemperatur, so ist es relativ einfach und sicher zu handhaben. Es ist auch einfach, Stickstofftrifluorid zu verwenden, um ein energetisches oder reaktives Gas oder ein Plasma zu bilden—ein Gas mit freien Elektronen. Die relativ lange Lebensdauer von Fluorradikalen im Plasma macht Stickstofftrifluorid zu einem effizienten Reiniger.,
Verwendungen
Stickstofftrifluorid wurde in großen Mengen erfolgreich als Fluor-Quelle für energiereiche chemische Laser eingesetzt. Es wird bevorzugt Überfluor wegen seiner vergleichenden Leichtigkeit der Handhabung bei Umgebungsbedingungen.
In jüngster Zeit wird eine zunehmende Menge Nitrogentrifluorid in der Halbleiterindustrie als Trockenätzmittel verwendet, was im Vergleich zu Kohlenstofftetrafluorid und Gemischen aus Kohlenstofftetrafluorid und Sauerstoff signifikant höhere Ätzraten und Selektivitäten aufweist.,
Stickstofftrifluorid wurde auch als Oxidationsmittel in der Raketentechnik in den frühen 1960er Jahren verwendet, aber diesanwendung wurde nicht kommerzialisiert.
Zubereitung
Stickstofftrifluorid wird durch Elektrolyse von entweder geschmolzenem Ammoniumfluorid, NH4F oder geschmolzenem Ammoniumsäurefluorid, NH4HF2 (oder Ammoniumfluorid in wasserfreiem HF) hergestellt. Während die NH4F-Methode bevorzugt wird, weil sie Stickstofftrifluorid als einziges Produkt bildet, ergibt die Elektrolyse von Ammoniumsäurefluorid eine geringe Menge an Dinitrogendifluorid,N2F2 und NF3.,
Stickstofftrifluorid kann auch durch Reaktion von Ammoniak mit mit Stickstoff verdünntem Fluor in einem mit Kupfer verpackten Reaktor hergestellt werden. Andere Stickstofffluoride, wie N2F2, N2F4 und NHF2 werden ebenfalls hergestellt. Die Ausbeute des Produkts hängt vom Fluor/Ammoniak-Verhältnis und anderen Bedingungen ab.
Herstellungsverfahren
Stickstofftrifluorid kann aus einer Vielzahl chemischer Reaktionen gebildet werden. Das kommerzielle Verfahren zur Herstellung beinhaltet die direkte Fluorierung von Ammoniak mit Fluorgas in Gegenwart Vonammoniumfluorid.,
Reaktionen
Wasserstoff reagiert mit Stickstofftrifluorid mit der schnellen Freisetzung großer Wärmemengen und ist die Grundlage für den Einsatz von Stickstofftrifluorid in hochenergetischen chemischen Lasern. Der Entflammbarkeitsbereich für Stickstofftrifluorid-Wasserstoff-Gemische beträgt 9,4 Molprozent bis 95 Molprozent Stickstofftrifluorid. Stickstofftrifluorid reagiert mit organischen Verbindungen, aber im Allgemeinen ist eine erhöhte Temperatur erforderlich, um die Reaktion auszulösen., Unter diesen Bedingungen verläuft die Reaktion oft explosiv, und bei der Exposition von Stickstofftrifluorid gegenüber organischen Verbindungen ist große Vorsicht geboten. Daher hat Stickstofftrifluorid als Fluorierungsmittel für organische Verbindungen wenig Verwendung gefunden.
Allgemeine Beschreibung
Ein farbloses Gas mit einem schimmeligen Geruch. Sehr giftig beim einatmen. Leicht löslich in Wasser. Ätzend auf Gewebe. Bei längerer Brand – oder Hitzeeinwirkung können die Behälter heftig reißen und platzen. Wird zur Herstellung anderer Chemikalien und als Bestandteil von Raketentreibstoffen verwendet.,
Luft & Wasserreaktionen
In Wasser leicht löslich.
Reaktivitätsprofil
Stickstofftrifluorid ist ein sehr starkes Oxidationsmittel. Stellt eine gefährliche Brandgefahr in Gegenwart von Reduktionsmitteln dar. Ätzt Glas in Gegenwart von Feuchtigkeit. Emittiert giftige und korrosive Fluoridddämpfe, wenn sie zur Zersetzung erhitzt werden . Kann heftig mit Wasserstoff, Ammoniak, Kohlenmonoxid, Diboran, Schwefelwasserstoff, Methan, Tetrafluorohydrazin, Holzkohle reagieren. Explosive Reaktion mit Chlordioxid., Eine schwere Explosion kann auftreten, wenn Reduktionsmittel unter Druck ausgesetzt werden .
Gefahr
Schwere Explosionsgefahr. Ätzend auf Gewebe. Methämoglobinämie, Leber-und Nierenschäden.
Gesundheitsgefahr
Einatmen stickstofftrifluorid kann reduzieren die Kapazität der roten Blut Zellen tragen Sauerstoff. Dies verursacht Zyanose oder eine bläuliche Verfärbung der Haut. Das Einatmen von Stickstofftrifluorid kann auch zu Kopfschmerzen, Schwindel, Schwäche und Verwirrung führen., Nach längerer Exposition gegenüber hohen Konzentrationen können der Abbau roter Blutkörperchen und Veränderungen in Leber, Nieren, Milz und Herzmuskel als sekundäre Wirkungen auftreten. An der frischen Luft werden sich die anfänglichen Veränderungen der roten Blutkörperchen über mehrere Stunden klären, aber die Person sollte immer noch auf sekundäre Effekte überwacht werden.
Brandgefahr
Substanz brennt nicht, unterstützt aber die Verbrennung. Einige reagieren möglicherweise explosiv mit Kraftstoffen. Kann brennbare Stoffe (Holz, Papier, Öl, Kleidung usw.) entzünden.). Dämpfe aus Flüssiggas sind zunächst schwerer als Luft und breiten sich am Boden aus., Abfluss kann Brand-oder Explosionsgefahr verursachen. Behälter können beim Erhitzen explodieren. Gebrochene Zylinder können auftreten.
Industrielle Anwendungen
Stickstofftrifluorid wurde erfolgreich in großen Mengen als Fluorquelle für hochenergetische chemische Laser eingesetzt. Es ist bevorzugt gegenüber Fluor wegen seiner vergleichenden Leichtigkeit der Handhabung bei Umgebungsbedingungen.,
In jüngster Zeit wird in der Halbleiterindustrie eine zunehmende Menge Stickstofftrifluorid als Trockenätzmittel verwendet, das im Vergleich zu Kohlenstofftetrafluorid und Gemischen aus Kohlenstofftetrafluorid und Sauerstoff signifikant höhere Ätzraten und Selektivitäten aufweist.
Stickstofftrifluorid wurde auch als Oxidationsmittel in der Raketentechnik in den frühen 1960er Jahren verwendet, aber diese Anwendung wurde nicht kommerzialisiert.
Materialverwendung
Bei Temperaturen unter 250°C hat Stickstofftrifluorid eine ähnliche Reaktivität wie Sauerstoff und ist relativ inert zu den meisten Baumaterialien., Bei Umgebungstemperaturen können Messing -, Aluminium -, Kupfer -, Stahl-und rostfreie Stähle mit Korrosionsraten von weniger als 0,1 mil/Jahr verwendet werden. bei 160°F (71,1°C) wurden für diese Materialien bestimmt. Stickstofftrifluorid ist auch mit fluorierten Werkstoffen wie z.B. temperatures.At erhöhte Temperaturen und Drücke, die Reaktivität von Stickstofftrifluorid nimmt zu und ähnelt mehr der von Fluor, wobei Nickel und Nickel die bevorzugten Baumaterialien sind.
Sicherheitsprofil
Ein Gift. Leicht giftig beim Einatmen., Längere Absorption maycause Mottling der Zähne, Skelettveränderungen.Schwere Explosionsgefahr durch chemische Reaktion mit Reduktionsmitteln, insbesondere unter Druck. Ein sehr gefährlicher Feuervogel; ein sehr starker Oxidner; otherwiseinert bei normalen Temperaturen und Drücken.
Potentielle Exposition
Dieses Material wurde in der chemischen Verwendetsynthese und als Oxidationsmittel für energiereiche Brennstoffe (Asan-Oxidationsmittel in Raketentreibstoffkombinationen).
Physiologische Effekte
ACGIH empfiehlt einen Grenzwert ValueTime-Weighted Average (TLV-TWA) des 10ppm (29 mgim3) für stickstofftrifluorid., Die DLV-TWA ist die zeitgewichtete Durchschnittskonzentration für einen 8-stündigen Arbeitstag und eine 40-stündige Arbeitswoche, denen fast alle Arbeitnehmer Tag für Tag ohne nachteilige Auswirkungen wiederholt ausgesetzt sein können.
OSHA listet eine 8-Stunden-zeitgewichtete durchschnittliche zulässige Expositionsgrenze (TWA-PEL)von 10 ppm (29 mg/m3) für Stickstofftrifluorid auf.TWA-PEL ist der Expositionsgrenzwert, der von der 8-Stunden-TWAin-8-Stunden-Schicht einer 40-Stunden-Arbeitswoche nicht überschritten werden darf.,
Die Toxizität von Stickstofftrifluorid hängt mit seiner Fähigkeit zusammen, Methämoglobin, ein modifiziertes, sauerstoffunfähiges Hämoglobin, zu fonnen und rote Blutkörperchen zu zerstören (Hämolyse). Nach Beendigung der Exposition kehrt Methämoglobin spontan zu Hämoglobin zurück. Bei hoher Exposition kann jedoch ein therapeutischer Eingriff erforderlich sein (Sauerstoff,Methylenblau, Austauschtransfusion). Das Auftreten von Hämolyse erfordert eine sorgfältige Überwachung für Grad der Anämie und das Potenzial fürbeeinträchtigte Nierenfunktion.,
Stickstofftrifluorid TLV-TWA-Wert von 10ppm resultierte aus einer Studie, die Ratten ausgesetzt 100 ppm für 7 Stunden pro Tag, 5 Tage pro Woche für 18 Monate. Es wurden keine Veränderungen des Verhaltens der Tiere, der Herz-oder Lungenraten, des Blutlevels oder des Auftretens von Fluorose festgestellt. ACGIH stellte den TLV-TWA auf III 0 des Testniveaus ein.
Gasförmiges Stickstofftrifluorid gilt als unschädlich für die Haut und als geringfügiger Reiz für die Speiseröhre und Schleimhäute.
Lagerung
Stickstofftrifluorid-Zylinder müssen während des Gebrauchs sicher abgestützt werden, um Bewegungen und Verspannungen von Verbindungen zu verhindern., Volle Zylinder müssen in einem gut belüfteten Bereich gelagert, vor übermäßiger Hitze (125°F oder 51,7°C) geschützt, von organischen oder brennbaren Materialien entfernt und gesichert werden. Ventilschutzkappen und Ventilauslasskappen müssen jederzeit sicher an Ort und Stelle sein, wenn der Zylinder nicht benutzt wird.
Versand
UN2451 Stickstofftrifluorid, Gefahrenklasse: 2.2; Etiketten: 2.2-Nicht brennbares Druckgas; 5.1-Oxidationsmittel.Zylinder müssen in einer sicheren aufrechten Position in einem gut belüfteten LKW transportiert werden. Schützen Sie Zylinder und Etiketten vorphysikalische Schäden., Der Besitzer der Druckgaszylinderist die einzige Einheit, die durch Bundesgesetz (49CFR) erlaubttransport und Nachfüllen. Es ist eine Verletzung des Transportesregelungen zum Nachfüllen von Druckgasflaschen ohne vorherige schriftliche Genehmigung des Eigentümers.
Toxizitätsbewertung
Die Toxizität von Stickstofftrifluorid hängt mit seiner Fähigkeit zusammen, Methämoglobin, eine modifizierte Fonn von Hämoglobin, die nicht in der Lage ist, Sauerstoff zu transportieren, und rote Blutkörperchen zu zerstören (Hämolyse). Nach Beendigung der Exposition kehrt Methämoglobin spontan zu Hämoglobin zurück., Bei hoher Exposition kann jedoch ein therapeutischer Eingriff erforderlich sein (Sauerstoff, Methylenblau, Austauschtransfusion). Das Auftreten von Hämolyse erfordert eine sorgfältige Überwachung für Grad der Anämie und das Potenzial für eine beeinträchtigte Nierenfunktion.
Inkompatibilitäten
Das Gas ist ein starkes Oxidationsmittel. Presentsdangerous Brandgefahr in Gegenwart von Reduktionsmitteln. Ätzt Glas in Gegenwart von Feuchtigkeit., Reagiert mitÖl, Fett, Reduktionsmittel und andere oxidierbare Materialien;brennbare Stoffe, organische Stoffe, Ammoniak,Kohlenmonoxid; Methan, Wasserstoff,Schwefelwasserstoff; Aktivkohle; Diboran, Wasser. Kann heftig mit Wasserstoff, Ammoniak,Kohlenmonoxid, Diboran, Schwefelwasserstoff, Methan, Tetrafluorohydrazin,Holzkohle reagieren. Stickstofftrifluorid erhöht die Intensität eines bestehenden Feuers.
Abfallentsorgung
Nachfüllbare Druckgasflaschen an Lieferanten zurückgeben., Entlüften Sie in großes Volumen Konzentriertreduktionsmittel (Bisulfite, Eisensalze oder Hypo)Lösung, dann neutralisieren und spülen in die Kanalisation mit großenvolumina von Wasser.
VERFÜGBARE GRADE
Stickstofftrifluorid ist in Qualitäten von 98 Prozent bis 99,995 Prozent v/vminimum Reinheit erhältlich.
