6.3 hur är energi relaterad till strålningens våglängd?
Vi kan tänka på strålning antingen som vågor eller som enskilda partiklar som kallas fotoner. Den energi som är associerad med en enda foton ges av E = hv, där E är energin (SI-enheter av J), h är Plancks konstant (h = 6,626 x 10-34 J s) och ν är strålningsfrekvensen (SI–enheter av S-1 eller Hertz, Hz) (se figur nedan)., Frekvensen är relaterad till våglängd med λ = c / ν, där C, ljusets hastighet, är 2,998 x 108 m s-1. En annan mängd som du ofta ser är vågantal, σ = 1 / λ, vilket vanligtvis rapporteras i enheter av cm-1.
energin hos en enda foton som har våglängden λ ges av:
e = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Energin hos en mol av fotoner som har våglängden λ finns genom att multiplicera ovanstående ekvation med Avogadros nummer:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
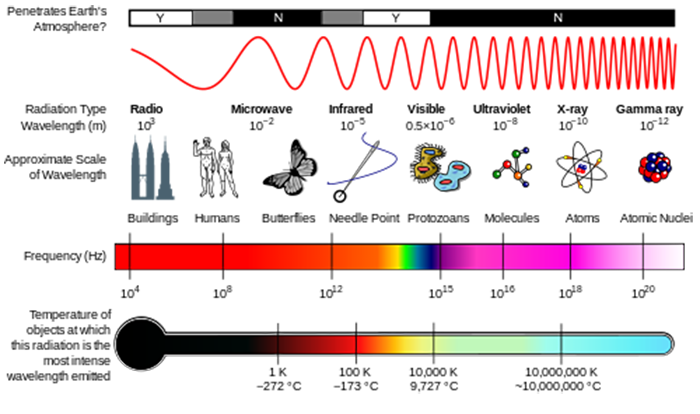
i lektionen om atmosfärisk sammansättning såg du hur Sol UV-strålning kunde bryta isär molekyler för att initiera atmosfärisk Kemi. Dessa molekyler absorberar energin hos en foton av strålning, och om den fotonenergin är större än styrkan hos den kemiska bindningen kan molekylen bryta ihop.
kontrollera din förståelse
överväga reaktionen O3 + UV → O2 + o*. Om bindningsstyrkan mellan O2 och O* (dvs.,, excited state oxygen atom) är 386 kJ mol-1, Vad är den längsta våglängden som en foton kan ha och fortfarande bryta detta band?
svar: lös för våglängd i ekvation
λ= 1.196 × 10 8 j nm mol -1 e m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
