d – och L – notationen för den absoluta konfigurationen av sockerarter och aminosyror
vad skiljer ” D-glukos ”från” L-glukos”? Eller D-alanin från L-alanin?
och vad är det här D – och L – nomenklaturen? Läs vidare:
Innehållsförteckning
- d – och L – ger en snabb stenografi för att beteckna enantiomerer
- Varför stör vi med denna gamla nomenklatur?,
- l – och D – systemet för tilldelning av ”absolut konfiguration”
- fyra-Kolaldehyd D – och l – sockerarter (Aldotetroser)
- fem-Kolaldehyd D-och L – sockerarter (Aldopentoser)
- sex-Kolaldehyd D – och L – sockerarter (Aldohexoser)
- men vänta – det finns mer! (Aminosyror)
- sammanfattning: D – och L – Notation för sockerarter och aminosyror
- anmärkningar
- (avancerade) referenser och vidare läsning
D – och L – ger en snabb stenografi för att beteckna enantiomerer
d – och L – notation ger en snabb stenografi för att beteckna enantiomerer.,
D-glukos är till exempel enantiomeren av L-glukos. Som L-alanin är enantiomeren av D-alanin.
det tilldelas enligt följande. För ett socker som dras i Fischer-projektionen med det mest oxiderade kolet högst upp (dvs. aldehyd eller keton)
- Om OH på den nedre Chirala mitten pekar åt höger kallas det D –
- Om OH på den nedre Chirala mitten pekar åt vänster kallas det L -.
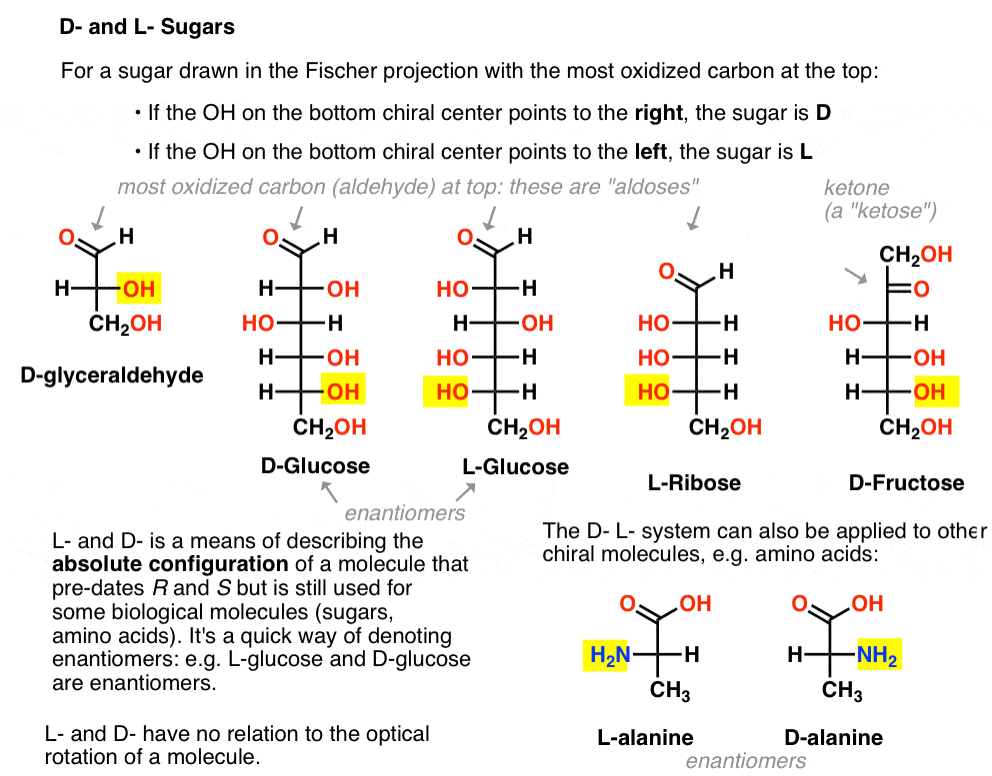
denna terminologi kan också tillämpas på aminosyror: se l – och D – alanin i bilden ovan.,
2. Varför Stör Vi Med Denna Gamla Nomenklatur?
Du kan med rätta fråga: har vi inte redan ett system för att tilldela absolut konfiguration ? Varför behöver vi ett nytt system?
d-l-systemet är inte ett nytt system, folk. Det är det gamla systemet – det föregår Cahn-Ingold-Prelog.
d-l-systemet är bokstavligen en kvarleva av häst-och-buggy-eran, som går tillbaka till Emil Fischers arbete med kolhydrater i slutet av 1800 – talet-en tid då organiska kemister inte hade något sätt att bestämma den absoluta konfigurationen av stereocenters, vilket bara blev möjligt 1951 (thx, Bijvoet).,
så varför används den fortfarande? Borde det inte skickas till historiens soptunna, tillsammans med glidregler, 8-spårkassetter och 5 ¼ ” disketter?
Tja, det finns blomstrande samhällen i delar av landsbygden Amerika där hästdragna vagnar kvarstår-om du vet var du ska leta. (Kanske en dag kommer det att finnas kommuner där människor bara använder 1970-och 1980-tals datateknik?)
likaså finns det en ficka av organisk kemi där d-l-systemet fortfarande finner användning, och det är specifikt inom området för sockerarter och aminosyror.,
detta är inte en revolt av Amish kemister mot de moderna ondskorna i CIP-systemet, förresten. Det finns minst 3 Goda skäl, i det specifika fallet med sockerarter och aminosyror, för användning av L – och D- :
- korthet. D-glukos är ett helvete mycket snabbare att skriva och säga än (2R,3S,4R,5R)2,3,4,5,6-pentahydroxihexanal. L – / D-systemet möjliggör konfigurationen av en molekyl med flera chirala centra för att sammanfattas med en enda bokstav (plus dess vanliga namn, naturligtvis – tack vare Noel för påminnelsen)
- mer korthet., Det råkar vara ett snabbt sätt att hänvisa till enantiomerer. Enantiomeren av L-glukos är D-glukos. Enantiomeren av L-Tryptofan är D-tryptofan. Och medan vi kunde använda ( + ) – eller ( – ) – prefixen för att skilja de två enantiomererna av glukos och andra sockerarter, kan tecknet på optisk rotation variera med lösningsmedel, temperatur, koncentration och andra faktorer som gör det mindre än idealiskt. Plus, l – och D-hänvisar specifikt till absolut konfiguration, medan (som vi noterade tidigare) det inte finns något enkelt samband mellan tecknet på optisk rotation och konfiguration.,
- Det visar sig att de flesta naturligt förekommande sockerarterna är D-, och de flesta naturligt förekommande aminosyrorna är L- . Det finns en enorm mängd information komprimerad i det uttalandet, och det finns inget konkurrerande system (r/s,+/–) som kan ersätta L – och D – med ett enda tecken. Obs
det bär upprepa: med sockerarter och aminosyror, L – och D – kan vara användbara beteckningar. För andra molekyler kan du i stor utsträckning glömma det.
Så vad är detta d-/L – system, och hur relaterar dessa termer till struktur?,
gå med mig när vi reser tillbaka genom tiden…
l – och D – systemet för att tilldela ”absolut konfiguration”
Emil Fischer började studera kolhydrater i slutet av 1880-talet. det var känt vid den tiden (via Van ’ t Hoff) att kol var tetrahedral, och det var också känt att molekyler som innehåller ett kol med fyra olika substituenter kunde rotera planpolariserat ljus (t.ex. Pasteur). Vad som inte var känt var den absoluta konfigurationen av någon av de Chirala molekylerna – vad vi skulle hänvisa till idag som deras ”R” och ”S” – konfigurationer.,
det enklaste kolhydratet som innehåller ett kiralt centrum är glyceraldehyd, c3h6o3. Glyceraldehyd har tre kol; vilket gör det till en ”triose”. Det mest oxiderade kolet i glyceraldehyd är en aldehyd, vilket också gör det till en ”Aldos”.
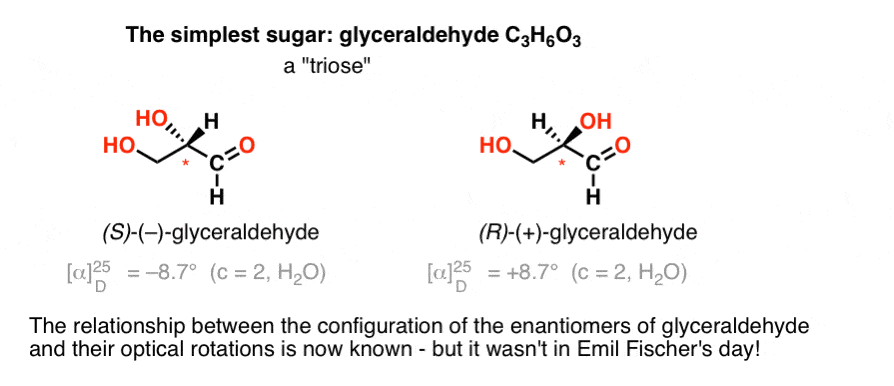
1888 hade de två enantiomererna av glyceraldehyd isolerats och karakteriserats., Men eftersom det inte finns någon enkel korrelation mellan konfigurationen av ett kiralt centrum och den riktning i vilken det roterar planpolariserat ljus, hade Emil Fischer inget sätt att binda tillbaka den optiska rotationen av ( + )-och ( – ) –glyceraldehyd till den absoluta konfigurationen av atomerna runt det kirala centrumet.
med hjälp av dagens terminologi hade han inget sätt att veta om (–)-glyceraldehyd var (r) eller (S).
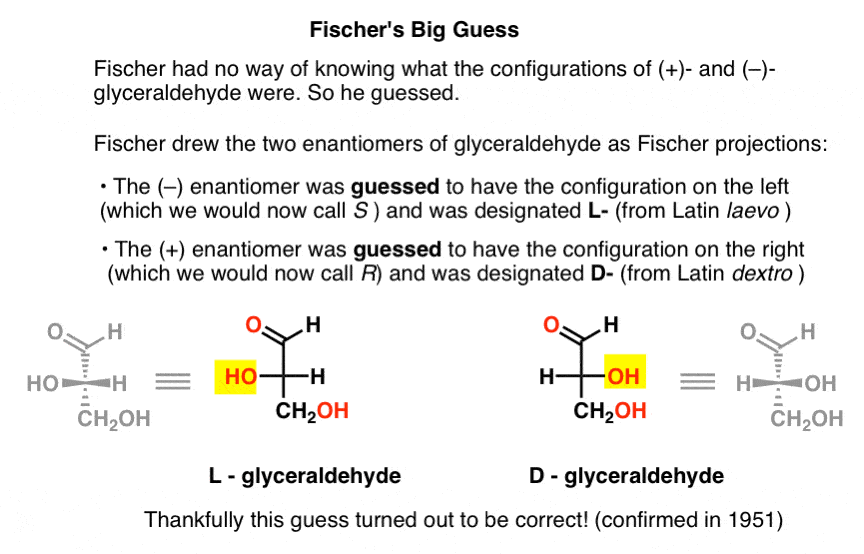
eftersom Fischer saknade denna viktiga information valde han att gissa.,
gissningen, som visade sig vara korrekt, var att (–)-glyceraldehyd hade konfigurationen vi nu kallar S, och att ( + )- glyceraldehyd har konfigurationen vi nu kallar R.
självklart, Cahn, Ingold och Prelog hade inte fötts än, och CIP-systemet skulle bara utvecklas efter Bijvoets arbete 1951. Så Fischer utvecklade sin egen nomenklatur.
ritning glyceraldehyd i vad som senare skulle kallas Fischer-projektionen, tilldelade han konfigurationen till vänster till (- ) – glyceraldehyd och kallade Den L – (kort för Latin laevo )., Han tilldelade sedan konfigurationen till höger ( + ) – glyceraldehyd, och kallade det D – (för Latin dextro).
Varför är det så viktigt?
att tilldela den absoluta konfigurationen för L-och d-glyceraldehyd var lite som att tilldela Prime Meridian (0° longitud) till Royal Observatory i Greenwich, England., Precis som longitud på alla andra platser på jorden kan sedan bestämmas i förhållande till den punkten om deras relativa avstånd var kända, kan den absoluta konfigurationen av alla andra stereocenter sedan bestämmas om dess konfiguration i förhållande till L – eller d – glyceraldehyd var känd.
det kanske inte är den tydligaste analogi. Så låt oss titta på 4-kol socker för ett annat exempel.,
fyra Kolaldehyd D – och L – sockerarter (Aldotetroser)
när de absoluta konfigurationerna av L – och d – glykeraldehyd föreslogs kunde de absoluta konfigurationerna av andra kirala föreningar sedan fastställas analogt (och mycket kemiskt grunt arbete).
det är inte avgörande för idag, men för ett exempel på denna typ av resonemang, se detta .
tillbaka när begreppet kirala centra introducerades lärde du dig sannolikt att en molekyl med n chirala centra kommer att ha 2N stereoisomerer (så länge det inte finns några meso-föreningar).,
det finns två fyrakolaldoser, Treos och erythrose. De har två kirala centra. Varje finns som ett par enantiomerer (L – och D- ) som ger totalt fyra stereoisomerer.
Här är de. Det viktiga att notera i figuren nedan är att l-familjen av sockerarter har OH-gruppen av det nedre Chirala kolet till vänster, och d-familjen har OH-gruppen av det nedre Chirala kolet till höger (markerat).,
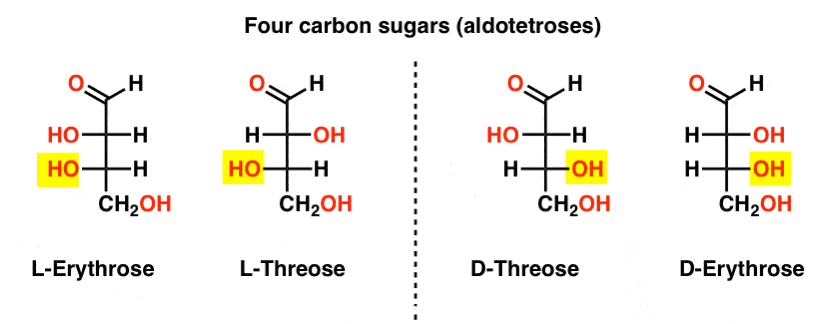
se hur l-Erythrose och L-Threose bygger på stereocentern som är etablerad i L-glyceraldehyd (markerad) och D-Erythrose och D-Threose bygger på stereocentern som är etablerad i d-glyceraldehyd (markerad).
sockerarter byggs upp lite som det binära systemet; Du kan tänka på varje stereocenter är en ” bit ” som kan ha ett av två värden. Konfigurationen av L-erythrose och L-threose skiljer sig endast vid en stereocenter. Om vi skulle vända positionen av H och OH, vi skulle få den andra., Detta förhållande har ett namn som du kan se ibland: två molekyler som har motsatt konfiguration på bara en stereocenter kallas epimers, särskilt när en av atomerna som är kopplade till stereocenteret är ett väte (H).
fem Kolaldehyd D – och L-sockerarter (Aldopentoser)
det mest kända namnet på den förteckningen bör vara ribos, som är ribonukleinsyrans socker ryggrad (RNA).
på vänster sida i diagrammet nedan har vi l-aldopentoserna, som alla delar samma konfiguration av det nedre stereocenteret när aldehyden placeras överst.,
deras enantiomerer, D-aldopentoser, är på höger sida, som alla delar samma konfiguration av botten stereocenter (markerad).
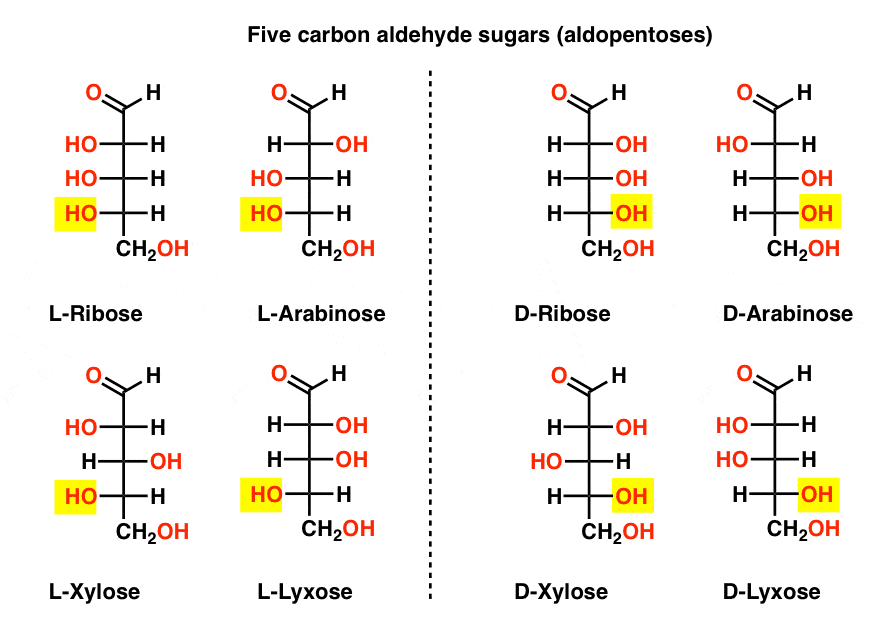
Vid denna tidpunkt bör vi påpeka att den överväldigande majoriteten av sockerarter i jordbaserade livsformer är d-sockerarter, inklusive D – ribos som ryggraden i RNA. Varför och hur alla organismer på jorden slutade med D-sockerarter är ett mysterium, eftersom man förutsätter att l-sockerarter skulle ha fungerat lika bra.,
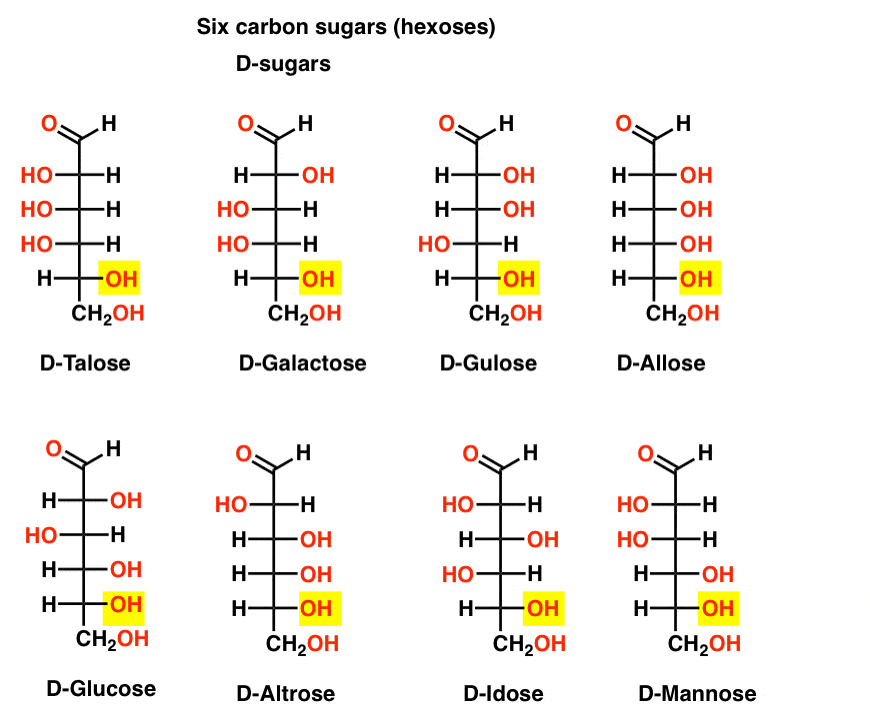
sex Kolaldehyd D-och L-sockerarter (Aldohexoser)
om det finns 4 aldopentoser, var och en som ett d – l – par enantiomerer (8 stereoisomerer totalt) hur många aldohexoser finns det?
det finns 8 d-l – par (totalt 16 stereoisomerer). Den mest kända är glukos, men du kommer sannolikt att känna igen mannos och galaktos. Vissa finns sällan, om någonsin, i naturen(idose, någon?).
Här är D-aldohexoserna. Observera hur de alla har samma konfiguration av det nedre chirala centrumet – samma som vi såg i d-glyceraldehyd.,
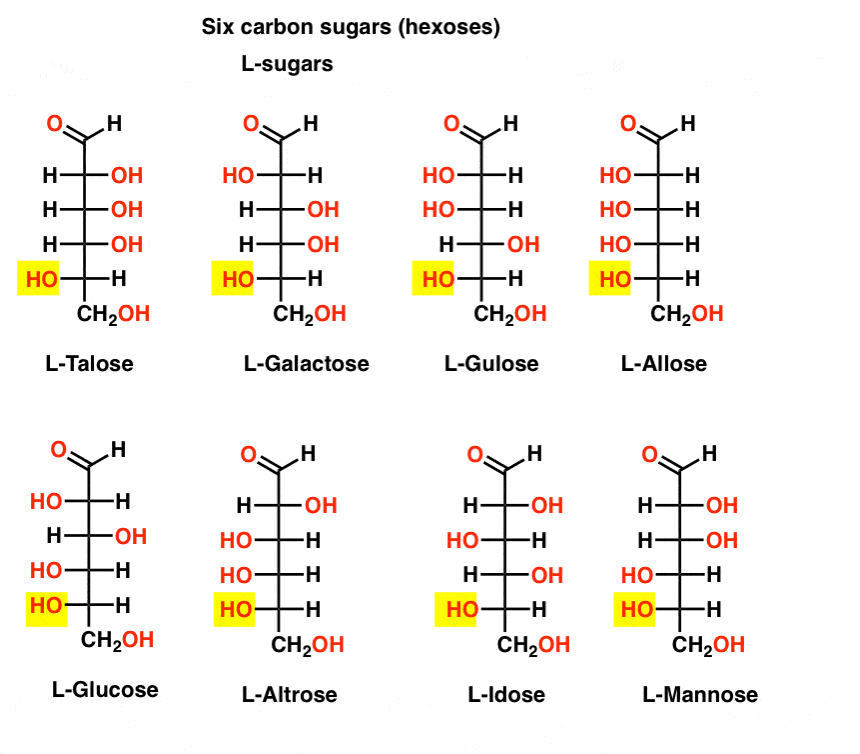
i motsats till d-sockerarterna finns L – sockerarterna (nedan) sällan i naturen. Intressant nog har L-glukos undersökts som ett sockersubstitut. Dess smak är oskiljbar från naturligt förekommande D-glukos, men ger ingen näring eftersom den inte kan brytas ner av våra (Chirala) enzymer. Som det visar sig är produktionen bara för dyr att konkurrera med splenda, stevia, aspartam et. al.
OK, det räcker. Sju kolsocker har gjorts (aldoheptoser) men de är inte biologiskt signifikanta.,
7. Men vänta – det finns mer! (Aminosyror)
om du ritar aminosyror i Fischer – projektionen med den mest oxiderade gruppen överst (karboxylsyran) kan du också tilldela l-och D -.
av de 19 kirala aminosyrorna som ingår i proteiner (proteinogen är den korrekta termen) är alla L- . (Glycin är achiral, så d – och L – gäller inte). Vissa D-aminosyror är naturligt förekommande, men de är sällsynta (oftast finns i bakterier, med det anmärkningsvärda undantaget av platypus venom) och kodas inte av mRNA.,
intressant, även om alla 19 Chirala aminosyror är L- , är endast 18 av 19 (Er). Vad är undantaget?
(detta är bra organisk kemi Bar trivia).
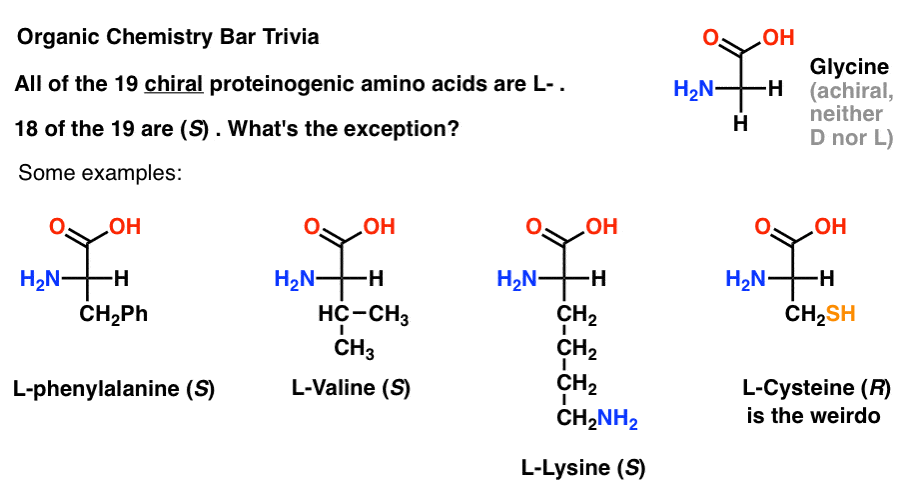
cystein är knäppgöken.
(bonuspoäng om du också sa selenocysteine … nerd).
sammanfattning: D – och L – Notation för sockerarter och aminosyror
så det är d – l-systemet för tilldelning av absolut konfiguration. Det fungerar bra för sockerarter eftersom de kan byggas upp så systematiskt (som det binära systemet). Det är också användbart för aminosyror., Den viktigaste punkten är bara att titta på botten stereocenter medan det dras i Fischer projektionen. Rätt? D. Vänster? L.
naturligtvis är sockerarter inte alltid så hjälpsamt ritade i Fischer-projektioner – de bildar ringar. Vi skriver om bestämning av D – och L-i cykliska sockerarter i ett framtida inlägg.
allt jag har att säga är, tack oavsett gudom du väljer att tro på att Fischers gissning visade sig vara korrekt. Det skulle vara en enorm smärta i röven att sålla igenom 70 + år av den kemiska litteraturen och veta att fel konfiguration hade tilldelats alla sockerarter och aminosyror.,
Tack vare Thomas Struble för hjälp med det här inlägget.
anmärkningar
anmärkning 1. ”den näst sista stereocentern i de flesta Chirala sockerarter är R, medan stereocenteret i de flesta aminosyror är S” inte har samma ring, särskilt eftersom cystein är R.]
Obs. Här är ett tankeexperiment för att bestämma de relativa konfigurationerna av erythrose och threose., (Jag säger ”tankeexperiment” eftersom jag inte vill inkludera specifika reagenser, vilket kan vara distraherande)
om man börjar med ren (+)-erytrose och oxiderar den primära alkoholen till en aldehyd med kända metoder, får man en förening som saknar någon optisk rotation. Detsamma gäller för ( – ) – erytrose, som returnerar en helt identisk förening. Av detta kan man dra slutsatsen att strukturen hos den nya föreningen måste vara sådan att molekylen har ett inre spegelplan (dvs det är meso). .,
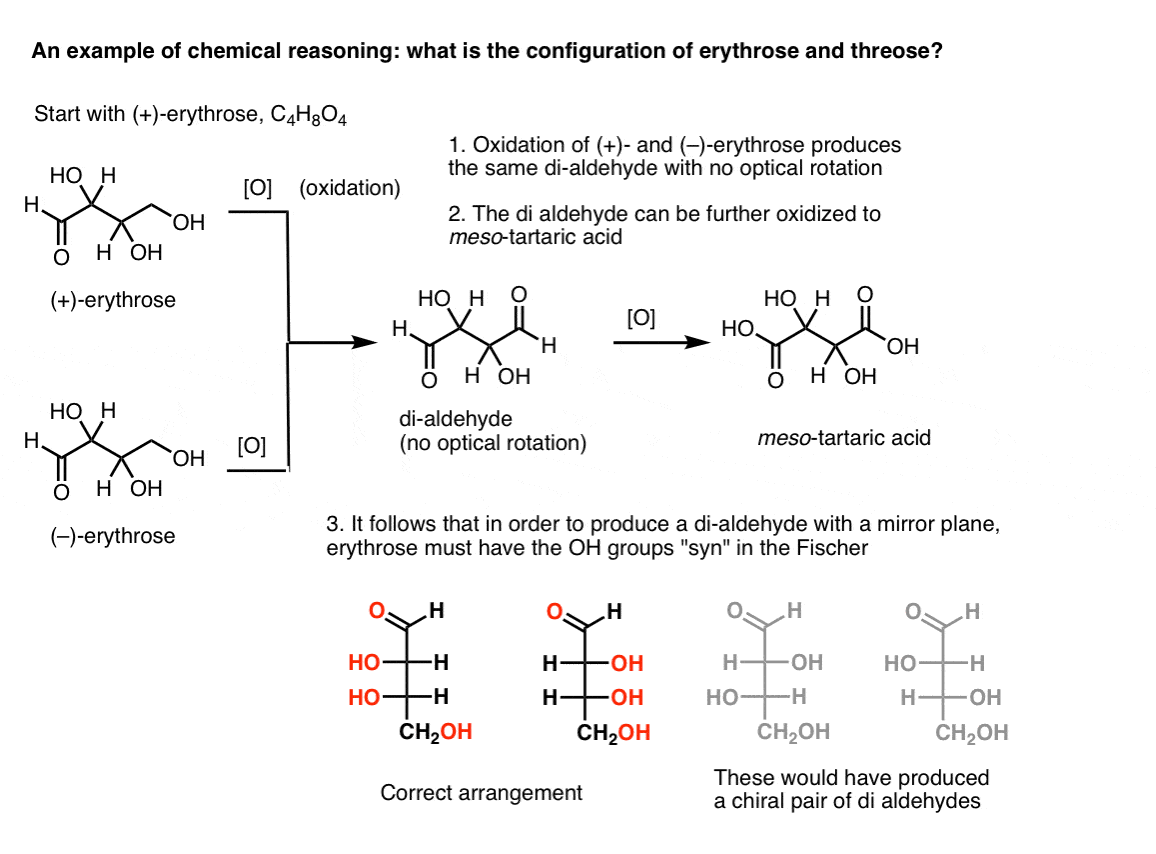
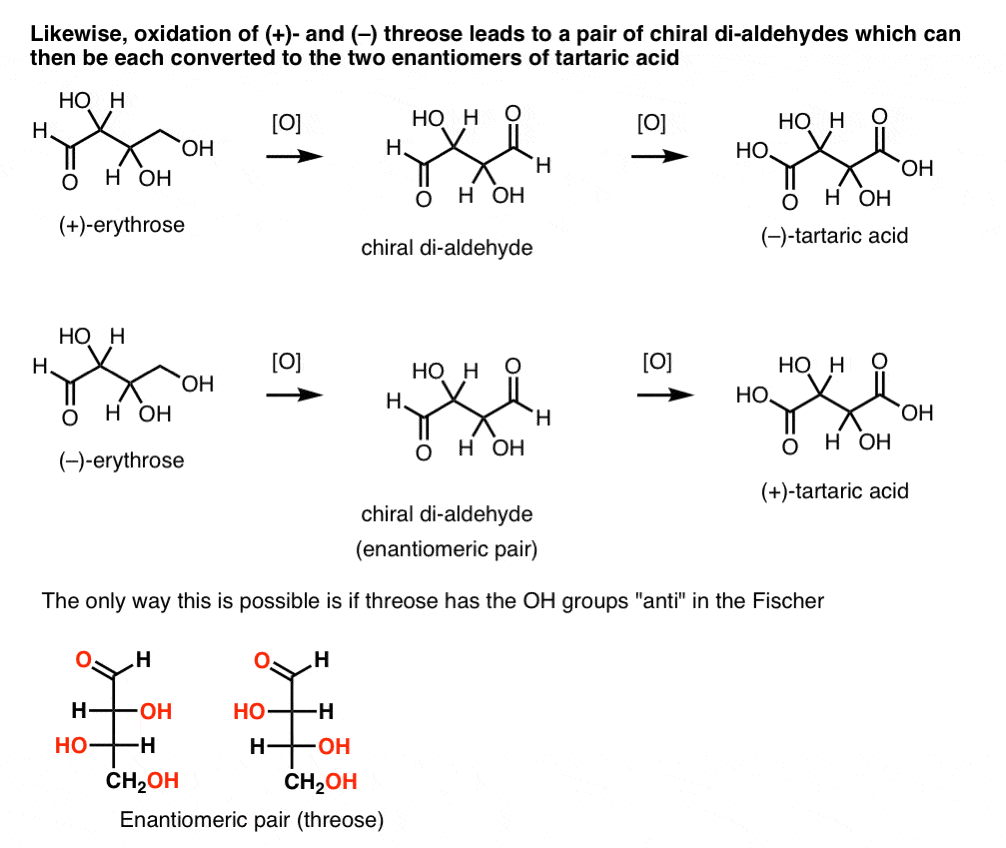
däremot utförs samma operation på (+)-Treos resulterar i en Di-aldehyd som upprätthåller optisk rotation. En förening med lika och motsatt optisk rotation bildas genom att utföra samma operation på (- ) – Treos. Dessa två föreningar är enantiomerer. För att detta ska vara sant måste den relativa orienteringen av hydroxylgrupperna i Treos vara anti. Dessa föreningar kan oxideras ytterligare för att producera respektive (–)- och (+)- vinsyra.,
samma resonemang kan användas i motsatt riktning (reduktion). Till exempel kan antingen ( + ) – eller ( – ) – erytrosen reduceras till tetraol erytritol, som är meso.
på samma sätt resulterar reduktion av (+)- och (–) Treos i ett enantiomeriskt par tetra-ols, treitol.
från dessa fakta kan vi härleda OH-gruppernas relativa orientering.
(Avancerad) Referenser och lästips
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d och l
Emil Fischer
Gruppundantagsförordningen. 1907, 40 (1), 102-106
DOI: 10.,1002/cber.19070400111
Detta är den berömda papper där Prof. Emil Fischer (godtyckligt!) tilldelad (- )-glyceraldehyd l-stereokemi. - syntetiserar i purin-och Sockergruppen
Emil Fischer
Nobelföreläsning, 1902Fischers Nobelföreläsning, där han talar om sitt arbete inte bara i kolhydrater utan även i puriner, varav föreningar som koffein och teobromin är medlemmar. Prof. Fisher förutspår ökningen av energidrycker (t. ex., Red Bull), som anger, ”med utövandet av en liten fantasi dagen kan förutses när bönor inte längre kommer att krävas för att göra gott kaffe: en liten mängd pulver från en kemisk fungerar tillsammans med vatten kommer att ge en smaklig, uppfriskande dryck förvånansvärt billigt”.
- bestämning av den absoluta konfigurationen av optiskt aktiva föreningar med hjälp av röntgenstrålar
BIJVOET, J., PEERDEMAN, A. & van BOMMEL, A.,
Natur 1951, 168, 271-272
DOI: 1038 / 168271a0
Den berömda papper som visade, med hjälp av röntgen strukturell analys, att ”Emil Fischer konvention, som tilldelade konfigurationen av Fig. 2 till dextrorotatory syra, verkar svara på verkligheten”. - Emil Fischer upptäckt av konfigurationen av glukos. En semicentennial retrospect
C. S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
DOI: 10.1021/ed018p353
en tidig recension som täcker Prof.Emil Fischer arbete i kolhydratkemi., - Emil Fischer bevis på konfigurationen av sockerarter: en Centennial hyllning
Frieder W. Lichtenthaler
Angew. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
en mycket läsbar recension från 1992 som täcker Prof.Fischers arbete inom kolhydratkemi och går djupt in i de stereokemiska tilldelningarna av kolhydrater.
