introduktion till karbonylgrupp
i organisk kemi är karbonylgrupp en funktionell grupp där kol-och syreatom är kopplade till en dubbelbindning. Föreningarna innehåller karbonylgrupp är kända som karbonylföreningar. Karbonylgrupp hänvisar till en kolmonoxid kan också fästas till en oorganisk atom som en ligand som kallas metallkarbonyl, t.ex. nickelkarbonyl.,
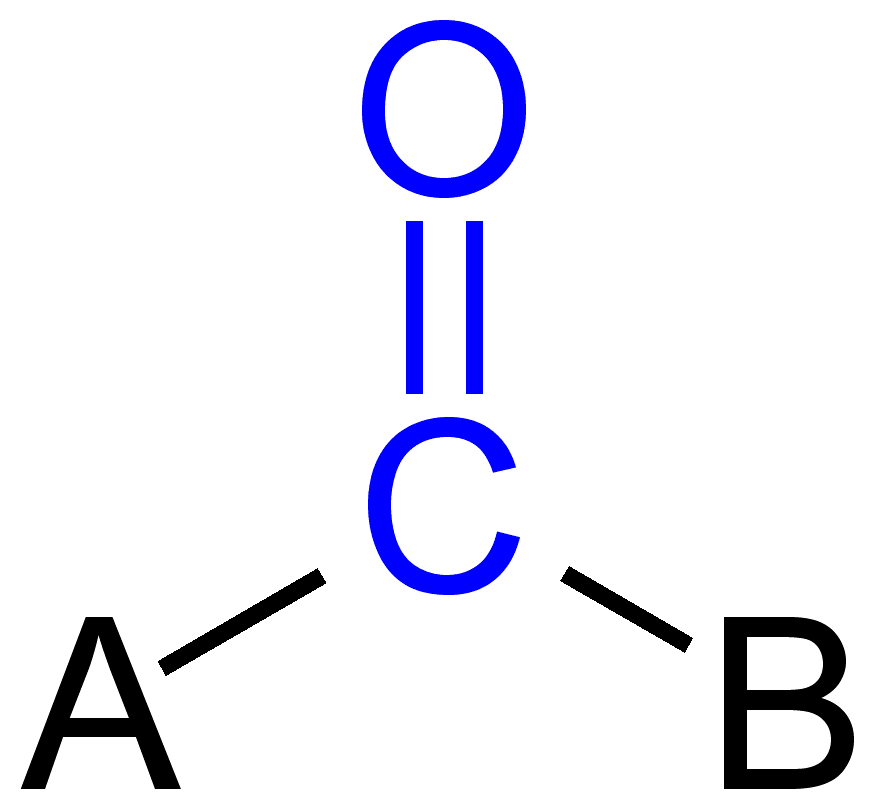
vissa karbonylgrupper
dubbelbindning i karbonylgrupp
kol-och syreatomen i karbonylgrupp är normalt sp2 hybridiserade och därmed plannar. På grund av närvaron av syre som en elektronegativ atom är dubbelbindningen i karbonylgruppen annorlunda än dubbelbindningen i alkener när det gäller reaktivitet. På grund av mer elektronegativitet och närvaro av två ensamma elektroner blir syre delvis negativ laddning medan karbonylkol genererar delvis positiv laddning och därmed polaritet observeras.,
Karbonylresonansstruktur
på grund av närvaron av syre som en elektronegativ atom visar karbonylgruppen resonansstruktur. Resonansstrukturen hos karbonylgruppen påverkar reaktiviteten hos föreningen. Den mer elektronegativa syreatomen drar bort elektron från kolcentret gör karbonylkolet delvis elektropositivt och syret delvis elektronegativt. Sålunda genererar polaritet inom karbonylföreningen.
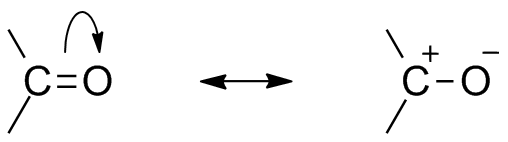
detta elektropositiva karbonylkol eller elektrofil kan nu attackeras av en nukleofil.,
reaktivitet
Karbonylalkylering
alkylering av karbonylgrupp genom nukleofil tillsats reaktion med användning Grignard reagens visas enligt följande:

fysikaliska egenskaper hos karbonylföreningar
- kokpunkten för aldehyder och ketoner är högre än kokpunkten för etrar och alkaner med liknande molekylmassa.
- återigen är kokpunkten för aldehyder och ketoner lägre än motsvarande alkoholer.,
- många högre aldehyder har behaglig lukt och används i parfymer eller som ett artificiellt smakämne medan den nedre medlemmen i deras homologa serie har skarp lukt.
- högre ketoner har intetsägande lukt och lägre har behaglig lukt, såsom aceton.
- små aldehyder och ketoner är lösliga i vatten men eftersom kedjans längd ökar lösligheten minskar.
- van der Waals dispersionsstyrkorna blir starkare när molekylerna blir längre.,
h-Bindning i karbonylgrupp
på grund av bildandet av H-bindning mellan karbonylsyret och väte av vattenmolekylen är de lägre karbonylföreningarna lösliga i vatten. Men när kedjan ökar, kommer den på väg att bilda vätebindning och lösligheten minskar.
Van der Waals dipol-dipol attraktion
på grund av polariteten i karbonylgruppen och närvaron av dispersionskrafter kommer det att finnas en attraktion mellan två närliggande molekyler. Detta orsakar kokpunkten för karbonylföreningar går högre än motsvarande alkaner., I följande tabell Observera att kokpunkten för karbonylföreningar är högre än motsvarande alkaner och lägre än alkoholerna.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Vanligtvis visar absorptionen av infraljus vid vid vågantal cirka 1600-1900 cm – 1 (5263 nm till 6250 nm).
kärnmagnetisk resonans
kol-NMR av karbonylkol visar topp ungefär mellan 160-220 ppm.
