6.3 hvordan er energi relateret til strålingsbølgelængden?
Vi kan tænke på stråling enten som bølger eller som individuelle partikler kaldet fotoner. Den energi, der er forbundet med en enkelt foton , er givet ved E = hv, hvor E er energien (SI–enheder af J), h er Plancks konstant (h = 6.626 10 10-34 JS), og ν er frekvensen af strålingen (SI-enheder af s-1 eller Hert., h.) (SE figuren nedenfor)., Frekvens er relateret til bølgelængde med= = C / ν , hvor c, lysets hastighed, er 2.998.108 m s–1. En anden mængde, som du ofte vil se, er waavenumber,= = 1/., som ofte rapporteres i enheder af cm–1.
energien af en enkelt foton, der har bølgelængden λ, er givet ved:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Energien af en mol fotoner, der har bølgelængden λ, findes ved at multiplicere ovenstående ligning med Avogadros nummer:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
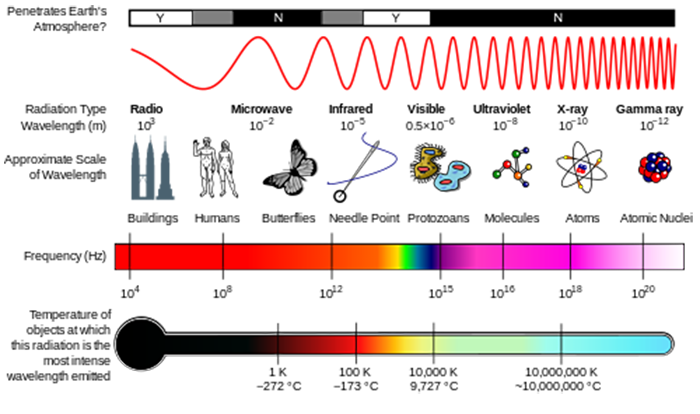
i lektionen om atmosfærisk sammensætning så du, hvordan solens UV-stråling var i stand til at adskille molekyler for at indlede atmosfærisk Kemi. Disse molekyler absorberer energien fra en foton af stråling, og hvis denne fotonenergi er større end styrken af den kemiske binding, kan molekylet bryde fra hinanden.
Tjek din forståelse
overvej reaktionen O3 + UV.O2 + O*. Hvis bindestyrken mellem O2 og O * (dvs.,, e ?citeret tilstand o oxygenygenatom) er 386 kJ mol–1, Hvad er den længste bølgelængde, som en foton kan have og stadig bryde denne binding?
svar: løs for bølgelængde i ligning
λ= 1.196 10 10 8 J nm mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
