som du kan se i Figur1, varierer nukleotiderne kun lidt og kun i den nitrogenholdige base. I tilfælde af DNA er disse baser adenin, guanin, cytosin og thymin. Bemærk ligheden mellem formerne af adenin og guanin, og også ligheden mellem cytosin og thymin. A og G klassificeres som puriner, mens C og T klassificeres som pyrimidiner. Så længe vi navngiver ting, Bemærk “deo .yribose “og”ribose”. Som navnet antyder, er deo .yribose bare en ribose uden ilt., Mere specifikt, hvor der er en hydro .ylgruppe bundet til 2-carbon af ribose, er der kun et hydrogen bundet til 2-carbon af DEO .yribose. Det er den eneste forskel mellem de to sukkerarter.
Ved tilfældigt konstruktion af en enkelt streng af nukleinsyre in vitro er der ingen særlige regler for bestilling af nukleotiderne med hensyn til deres baser. Identiteten af deres nitrogenholdige baser er irrelevant, fordi nukleotiderne er bundet af phosphodiesterbindinger gennem fosfatgruppen og pentosen., Det kaldes derfor ofte sukker-fosfat-rygraden. Hvis vi nedbryder ordet” phosphodiester”, ser vi, at det ganske behændigt beskriver forbindelsen: sukkerne er forbundet med to esterbindinger ( —O—) med en fosfor imellem. Et af de ideer, der ofte forvirrer eleverne, er retningen af denne binding og derfor af nukleinsyrer generelt. For eksempel, når vi taler om DNA-polymerase, en .ymet, der katalyserer tilsætningen af nukleotider i levende celler, siger vi, at det virker i en 5-prime (5′) til 3-prime (3′) retning., Dette kan virke som arcane molekylær-biolog-tale, men det er faktisk meget simpelt. Se endnu et kig på to af nukleotiderne sammenføjet af phosphodiesterbindingen (figur \(\Pageinde. {1}\) nederst til venstre). Et adeninnukleotid er forbundet med et cytosinnukleotid. Phosphodiesterbindingen vil altid forbinde 5-carbon af en deo .yribose (eller ribose i RNA) til 3-carbon af det næste sukker. Dette betyder også, at der i den ene ende af en kæde af bundne nukleotider vil være en fri 5′ phosphat (-PO4) gruppe, og i den anden ende en fri 3′ hydro .yl (-OH)., Disse definerer retningen af en streng af DNA eller RNA.

DNA findes normalt som et dobbeltstrenget molekyle i cellen, mens RNA for det meste er enkeltstrenget., Det er dog vigtigt at forstå, at DNA under de rette betingelser kan gøres enkeltstrenget, og RNA kan være dobbeltstrenget. Faktisk er molekylerne så ens, at det endda er muligt at skabe dobbeltstrengede hybridmolekyler med en DNA-streng og en af RNA. Det er interessant, RNA-RNA-dobbelt-helices og RNA-DNA dobbelt helices er faktisk lidt mere stabile end de mere konventionelle DNA-DNA dobbelt helix.,
grundlaget for DNA ‘ s dobbeltstrengede natur og faktisk grundlaget for nukleinsyrer som medium til opbevaring og overførsel af genetisk information er baseparring. Baseparring refererer til dannelsen af hydrogenbindinger mellem adeniner og thyminer og mellem guaniner og cytosiner. Disse par er betydeligt mere stabile end nogen forening dannet med de andre mulige baser. Endvidere, når disse basepar-foreninger dannes i sammenhæng med to strenge af nukleinsyrer, er deres afstand også ensartet og meget stabil., Du husker måske, at hydrogenbindinger er relativt svage bindinger. I forbindelse med DNA er hydrogenbindingen imidlertid det, der gør DNA ekstremt stabilt og derfor velegnet som et langtidslagringsmedium til genetisk information. Da selv i enkle prokaryoter er DNA – dobbeltspiral mindst tusinder af nukleotider lange, betyder det, at der er flere tusinde hydrogenbindinger, der holder de to tråde sammen., Selvom enhver individuel nukleotid-til-nukleotid-hydrogenbindingsinteraktion let kunne forstyrres midlertidigt af en lille stigning i temperaturen eller en minimal ændring i opløsningens ionstyrke, kræver en fuld dobbelt-Heli.af DNA meget høje temperaturer (generelt over 90oC) for fuldstændigt at denaturere den dobbelte Heli. i individuelle tråde.
fordi der er en nøjagtig en-til-en – parring af nukleotider, viser det sig, at de to tråde i det væsentlige er sikkerhedskopier af hinanden-et sikkerhedsnet i tilfælde af, at nukleotider går tabt fra en streng., Selv om dele af begge tråde er beskadiget, så længe den anden streng er intakt i skadeområdet, er de væsentlige oplysninger stadig der i den komplementære sekvens af den modsatte streng og kan skrives på plads. Husk dog, at mens den ene streng af DNA således kan fungere som en “backup” af den anden, er de to tråde ikke identiske – de er komplementære. En interessant konsekvens af dette system af komplementære og antiparallelle tråde er, at de to tråde hver kan bære unikke oplysninger.,
tovejsgenpar er to gener på modsatte DNA-strenge, men deler en promotor, som ligger imellem dem. Da DNA kun kan fremstilles i en retning, 5 ’til 3′, sender denne tovejs promotor, ofte en CpG-ø (se næste kapitel), RNA-polymerasen for hvert gen i modsatte fysiske retninger. Dette har vist sig for en række gener involveret i kræftformer (bryst, æggestok) og er en mekanisme til koordinering af ekspressionen af netværk af genprodukter.
strengene af en DNA-dobbelt-Heli.er antiparallelle., Dette betyder, at hvis vi kiggede på en dobbelt-Heli.af DNA fra venstre mod højre, ville en streng være konstrueret i 5′ til 3′ – retningen, mens den komplementære streng er konstrueret i 3′ til 5′ – retningen. Dette er vigtigt for funktionen af en .ymer, der skaber og reparerer DNA, som vi snart vil diskutere. I figur \(\Pageinde. {1}\) er den venstre streng 5′ til 3′ fra top til bund, og den anden er 5′ til 3′ fra bund til top.
fra et fysisk synspunkt er DNA-molekyler negativt ladede (alle disse fosfater) og normalt en dobbelt-Heli.med en højrehåndet t .ist., I denne normale (også kaldet “B” konformation) tilstand omfatter en fuld T .ist af molekylet 11 basepar med 0,34 nm mellem hver nukleotidbase. Hver af de nitrogenholdige baser er Plane, og når de er parret med den komplementære base, danner en at Plan “rung” på “stigen” af DNA. Disse er vinkelret på DNA ‘ ets længdeakse. Det meste af det fritflydende DNA i en celle og det meste DNA i en hvilken som helst vandig opløsning af næsten fysiologisk osmolaritet og pH findes i denne B-konformation., Imidlertid er der fundet andre konformationer, normalt under meget specifikke miljøforhold. En komprimeret konformation, A-DNA, blev observeret som en artefakt af in vitro krystallisation, med lidt flere baser pr.tur, kortere drejelængde, og basepar, der ikke er vinkelret på længdeaksen. En anden, DNA-DNA, synes at danne forbigående i GC-rige strækninger af DNA, hvor, interessant, DNA vrider den modsatte retning.
det er blevet foreslået, at både A-og Z-formerne af DNA faktisk er fysiologisk relevante., Der er tegn på, at a-formen kan forekomme i RNA-DNA hybrid dobbelt helices såvel som når DNA er kompleks til nogle en .ymer. Conform-konformationen kan forekomme som reaktion på methylering af DNA ‘ et. Desuden er den “normale” B-DNA-konformation noget af en idealiseret struktur baseret på at være fuldt hydreret, hvilket bestemt er meget sandsynligt inde i en celle. Imidlertid ændrer denne hydratiseringstilstand konstant, omend minutiøst, så DNA-konformationen vil ofte variere lidt fra B-konformationsparametrene i figur \(\Pageinde. {2}\).,
i prokaryoter findes DNA ‘et i cytoplasmaet (temmelig indlysende, da der ikke er noget andet valg i disse enkle organismer), mens DNA’ et i eukaryoter findes inde i kernen. På trods af forskellene i deres placeringer er beskyttelsesniveauet mod eksterne kræfter og mest af alt deres størrelser, både prokaryotisk og eukaryotisk DNA, pakket med proteiner, der hjælper med at organisere og stabilisere den samlede kromosomstruktur., Relativt lidt forstås med hensyn til prokaryotisk kromosomal emballage, selv om der er strukturelle ligheder mellem nogle af proteinerne, der findes i prokaryote og eukaryote kromosomer. Derfor holder de fleste indledende cellebiologiske kurser sig til eukaryotisk kromosomal emballage.

nøgen DNA, hvad enten det er prokaryotisk eller eukaryotisk, er en ekstremt tynd streng af materiale, omtrent 11 nm i diameter. Men i betragtning af størrelsen af eukaryote genomer, hvis DNA ‘ et blev opbevaret på den måde inde i kernen, ville det blive uhåndterligt sammenflettet. Forestil dig en spand, i hvilken du har kastet hundrede meter garn uden noget som helst forsøg på at organisere det ved at vikle det eller samle det., Overvej nu, om du ville være i stand til at nå ind i spanden træk på en streng, og forvent kun at trække en streng op, eller hvis du i stedet sandsynligvis trækker mindst en lille flok garn op. Cellen gør i det væsentlige, hvad du ville gøre med garnet for at holde det organiseret: det pakkes pænt i mindre, håndterbare skind. I tilfælde af DNA Løkkes hvert kromosom omkring et histonkompleks for at danne den første rækkefølge af kromosomal organisation: nukleosomet.
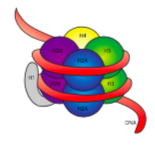
30-nm fiberen holdes sammen af to sæt interaktioner. For det første bringer linker histonen, H1, nukleosomerne sammen i en omtrentlig 30 nm struktur., Denne struktur stabiliseres derefter af disulfidbindinger, der dannes mellem H2A-histonen af et nukleosom og H4-histonen af dets nabo.
histoner er en familie af basale (positivt ladede) proteiner. De fungerer alle primært i at organisere DNA, og nukleosomet dannes, når DNA ombrydes (lidt over 2 gange) omkring en kerne på otte histoner – to hver af H2A, H2B, H3 og H4. Antallet og placeringen af de positive ladninger (for det meste fra lysines og argininer) er afgørende for deres evne til at binde stramt DNA, der som tidligere påpeget, er meget negativt ladet., At” modsætninger tiltrække ” id.er ikke bare en dating tip fra rådgivning kolonner.

Efter en gennemgang af 3D-struktur af histon kernen komplekse, ser vi, at mens relativt ladede protein interaktion domæner hold histoner sammen i midten, de positivt ladede rester er fundet rundt omkring ydersiden af komplekset, der er tilgængelig til at interagere med de negativt ladede fosfater af DNA.,
i et senere kapitel vil vi diskutere, hvordan en .ymer læser DNA ‘ et for at transkribere dets information til mindre, mere håndterbare stykker RNA. For øjeblikket behøver vi kun at være opmærksomme på, at meget af DNA ‘et til enhver tid er pakket tæt væk, mens nogle dele af DNA’ et ikke er. Da de dele, der er tilgængelige til brug, kan variere afhængigt af hvad der sker med/i cellen på et givet tidspunkt, skal emballagen af DNA være dynamisk. Der skal være en mekanisme til hurtigt at løsne bindingen af DNA til histoner, når dette DNA er nødvendigt for genekspression, og for at stramme bindingen, når den ikke er det., Som det viser sig, involverer denne proces acetylering og deacetylering af histonerne.

Histonacetyltransferaser (hatte) er en .ymer, der placerer en acetylgruppe på et lysin af et histonprotein. Acetylgrupperne er negativt ladede, og acetyleringen tilføjer ikke kun en negativt ladet gruppe, den fjerner også den positive ladning fra lysinen. Dette har den virkning ikke kun at neutralisere et tiltrækningspunkt mellem proteinet og DNA ‘ et, men endda lidt afvise det (med lignende ladninger)., På den anden side af mekanismen er Histondeactylaser (Hdac ‘ er) en .ymer, der fjerner acetyleringen og derved genopretter interaktionen mellem histonprotein og DNA. Da disse er så vigtige en .ymer, står det til grund, at de ikke må operere willyilly-nilly på nogen tilgængelig histon, og faktisk findes de ofte i et kompleks med andre proteiner, der styrer og koordinerer deres aktivering med andre processer, såsom aktivering af transkription.
