Introduktion til carbonyl-gruppen
I organisk kemi, carbonyl-gruppen er en funktionel gruppe, hvor kulstof og ilt atom er forbundet med en dobbeltbinding. Forbindelserne indeholder carbonylgruppe er kendt som carbonylforbindelser. Carbonylgruppe henviser til en carbonmono .id kan også bundet til et uorganisk atom som en ligand, der kaldes metalcarbonyl, f.nikkelcarbonyl.,
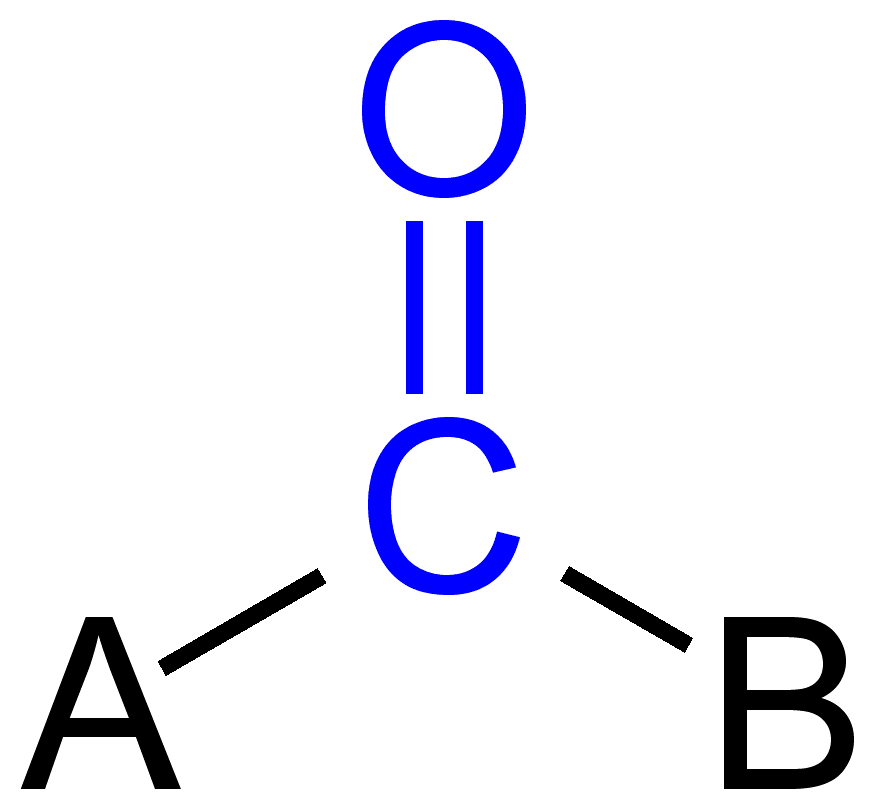
nogle carbonylgrupper
dobbeltbinding i carbonylgruppen
carbon-og O .ygenatomet i carbonylgruppen er normalt sp2-hybridiseret og dermed planmæssigt. På grund af tilstedeværelsen af O .ygen som et elektronegativt atom er dobbeltbindingen i carbonylgruppen forskellig fra dobbeltbindingen i alkener med hensyn til reaktivitet. På grund af mere elektronegativitet og tilstedeværelse af to ensomme par elektroner, ilt bliver delvist negativ ladning, mens carbonylcarbon genererer delvist positiv ladning, og således observeres polaritet.,
Carbonylresonansstruktur
på grund af tilstedeværelsen af O .ygen som et elektronegativt atom viser carbonylgruppen resonansstruktur. Resonansstruktur af carbonylgruppe påvirker forbindelsens reaktivitet. Den mere elektronegative ilt atom trækker væk elektron fra carbon center gør carbonyl-carbon delvist elektropositiv og ilt delvist elektronegative. Således genererer polaritet inden for carbonylforbindelsen.
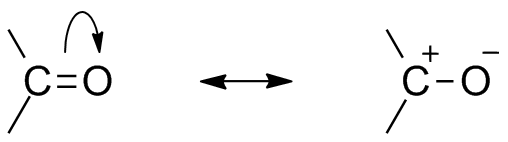
dette elektropositive carbonylcarbon eller elektrofil kan nu angribes af en nukleofil.,
Reaktivitet
Carbonyl Alkylering
Alkylering af carbonyl gruppe af nucleophilic desuden reaktion ved hjælp af Grignard-reagens er vist som følger:

Fysiske egenskaber af carbonyl forbindelser
- kogepunktet af aldehyder og ketoner er højere end kogepunkt ethere og alkaner af samme molekylvægt.
- igen er kogepunktet for aldehyder og ketoner lavere end de tilsvarende alkoholer.,
- mange højere aldehyder har behagelig lugt og bruges i parfume eller som en kunstig aroma, mens det lavere medlem af deres homologe serie har skarp lugt.
- højere ketoner har intetsigende lugt og lavere har behagelig lugt, såsom acetone.
- små aldehyder og ketoner er opløselige i vand, men når kædelængden øges, falder opløseligheden.
- van der deraals dispersionskræfterne bliver stærkere, da molekylerne bliver længere.,
H-binding i carbonyl gruppe
på Grund af dannelsen af H-binding mellem carbonyl ilt og brint af vand molekyle, lavere carbonyl forbindelser er opløselige i vand. Men når kæden stiger, kommer den på vej til dannelse af hydrogenbinding, og opløseligheden falder.
Van Der dipaals dipol-dipol-tiltrækning
På grund af polariteten i carbonylgruppen og tilstedeværelsen af dispersionskræfter vil der være en tiltrækning mellem to nærliggende molekyler. Dette får kogepunktet for carbonylforbindelser til at gå højere end de tilsvarende alkaner., I følgende tabel bemærkes, at kogepunktet for carbonylforbindelser er højere end de tilsvarende alkaner og lavere end alkoholerne.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Normalt viser absorptionen af infrarøde lys ved at waavenumbers ca.1600-1900 cm−1 (5263 nm til 6250 nm).
kernemagnetisk resonans
carbon-NMR af carbonylcarbon viser top omtrent mellem 160-220 ppm.
