D – og L-notationen for den absolutte konfiguration af sukker og aminosyrer
Hvad adskiller “D-Glucose” fra “L-Glucose” ? Eller D-alanin fra L-alanin?
og hvad er denne D – og L – nomenklatur, alligevel? Læs videre:
Indholdsfortegnelse
- D – og L – giver en hurtig stenografi til udpegning af enantiomerer
- hvorfor gider vi med denne gamle nomenklatur?,
- L – og D-systemet til tildeling af “absolut konfiguration”
- fire-Carbon aldehyd D-og L-sukkerarter (Aldotetroser)
- fem-Carbon aldehyd D – og L – sukkerarter (Aldopentoser)
- seks-Carbon aldehyd D – og L – sukkerarter (Aldohe !oser)
- men vent – der er mere! (Aminosyrer)
- resum.: D – og L – Notation for sukker og aminosyrer
- noter
- (avancerede) referencer og yderligere læsning
D – og L – giver en hurtig stenografi for udpegning af enantiomerer
D – og L – notation giver en hurtig stenografi for udpegning af enantiomerer.,
D-Glucose er for eksempel enantiomeren af L-Glucose. Som L-alanin er enantiomer af D-alanin.
det er tildelt som følger. For et sukker, der trækkes i Fischer – projektionen med det mest o .iderede kulstof øverst (dvs .aldehyd eller keton)
- hvis OH på det nederste chiralcenter peger mod højre, benævnes det D –
- hvis OH på det nederste chiralcenter peger mod venstre, benævnes det L -.
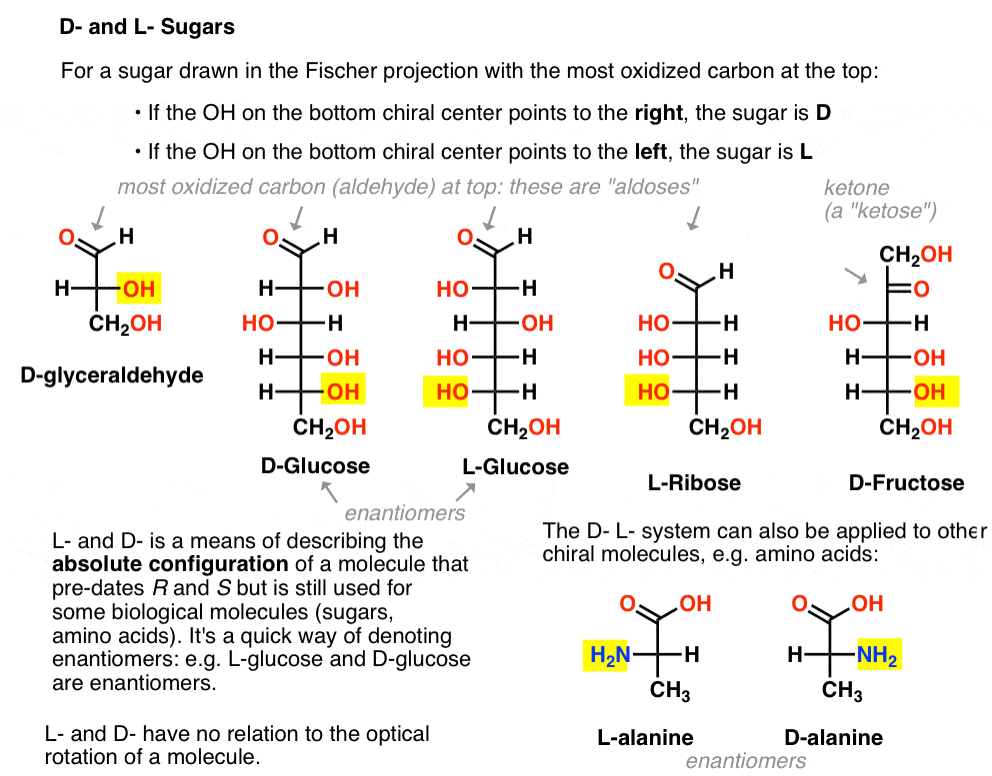
Denne terminologi kan også anvendes til aminosyrer: se L – og D – alanin på billedet ovenfor.,
2. Hvorfor Gider Vi Med Denne Gamle Nomenklatur?
Du kan med rette spørge: Har vi ikke allerede et system til tildeling af absolut konfiguration ? Hvorfor har vi brug for et nyt system?
D-l-systemet er ikke et nyt system, folk. Det er det gamle system-det foregår Cahn-Ingold-Prelog.
D-L system er bogstaveligt talt en rest af hest-og-buggy æra, der daterer tilbage til Emil Fischer ‘ s arbejde på kulhydrater i slutningen af 1800-tallet, en tid hvor organiske kemikere havde ingen måde til at bestemme den absolutte konfiguration af stereocenters, som kun blev muligt i 1951 (thx, Bijvoet).,
så hvorfor bliver det stadig brugt? Bør det ikke sendes til historiens skraldespand sammen med diasregler, 8-track kassetter og 5?” disketter?
Nå, der er blomstrende samfund i dele af det landlige Amerika, hvor hestevogne vedvarer-hvis du ved, hvor du skal kigge. (Måske en dag vil der være kommuner, hvor folk kun bruger 1970 ‘erne og 1980’ erne computerteknologi?)
ligeledes er der en lomme af organisk kemi, hvor D-L-systemet stadig finder anvendelse, og det er specifikt inden for sukker og aminosyrer.,
Dette er ikke et oprør fra Amish-kemikere mod CIP-systemets moderne onde, forresten. Der er mindst 3 gode grunde, i det specifikke tilfælde af sukker og aminosyrer, til at bruge L – og D- :
- kortfattethed. D-glucose er et helvede meget hurtigere at skrive og sige end (2R,3S,4R,5R)2,3,4,5,6-pentahydro .yhe .anal. L- / D-systemet gør det muligt at opsummere konfigurationen af et molekyle med flere chirale centre med et enkelt bogstav (plus dets almindelige navn, selvfølgelig – tak til Noel for påmindelsen)
- mere kortfattethed., Det sker for at være en hurtig måde at henvise til enantiomerer. Enantiomeren af L-glucose er D-glucose. Enantiomeren af L-tryptophan er D-tryptophan. Og selvom vi kunne bruge ( + ) – eller ( – ) – præfikserne til at differentiere de to enantiomerer af glukose og andre sukkerarter, kan tegnet på optisk rotation variere med opløsningsmiddel, temperatur, koncentration og andre faktorer, der gør det mindre end ideelt. Plus, L – og D – henviser specifikt til absolut konfiguration, mens (som vi tidligere har nævnt) der ikke er noget simpelt forhold mellem tegnet på optisk rotation og konfiguration.,
- det viser sig, at de fleste naturligt forekommende sukkerarter er D -, og de fleste naturligt forekommende aminosyrer er L- . Der er en enorm mængde information komprimeret i denne erklæring, og der er ikke noget konkurrerende system (R/S,+/–), som kunne erstatte L – og D – med et enkelt tegn. Bemærk
det bærer gentagelse: med sukker og aminosyrer kan L – og D – være nyttige betegnelser. For andre molekyler kan du stort set glemme det.
Så hvad er dette D- / L – system, og hvordan relaterer disse udtryk til struktur?,
Deltag i mig, mens vi rejser tilbage gennem tiden…
L – og D – systemet til tildeling af “absolut konfiguration”
Emil Fischer begyndte at studere kulhydrater i slutningen af 1880 ‘erne. Det var kendt på det tidspunkt (via Van’ t Hoff), at kulstof var tetrahedralt, og det var også kendt, at molekyler indeholdende et kulstof med fire forskellige substituenter kunne rotere planpolariseret lys (f.eks. Pasteur). Hvad der ikke var kendt var den absolutte konfiguration af nogen af de chirale molekyler – hvad vi i dag ville henvise til som deres “R” og “S” konfigurationer.,
det enkleste kulhydrat indeholdende et chiralt center er glyceraldehyd, C3H6O3. Glyceraldehyd har tre carbonatomer; gør det til en”triose”. Det mest o .iderede kulstof i glyceraldehyd er et aldehyd, hvilket også gør det til en “aldose”.
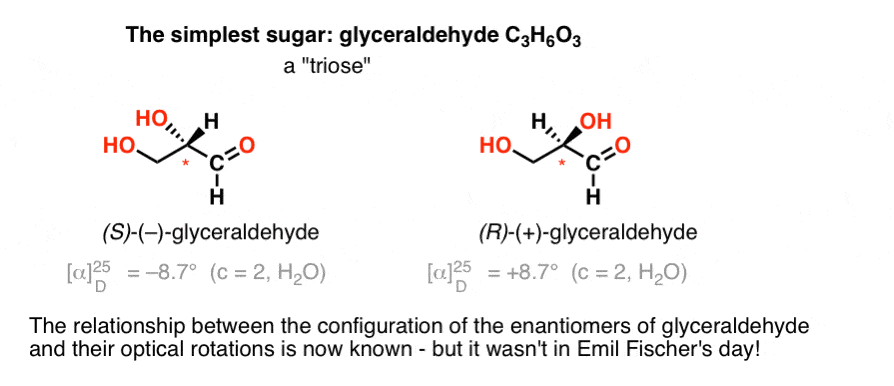
i 1888 var de to enantiomerer af glyceraldehyd blevet isoleret og karakteriseret., Men da der ikke er nogen simpel sammenhæng mellem konfigurationen af et chiralt center og retningen, hvori det roterer planpolariseret lys, havde Emil Fischer ingen måde at binde den optiske rotation af ( + )-og ( – ) –glyceraldehyd tilbage til den absolutte konfiguration af atomerne omkring det chirale Center.
Ved hjælp af dagens terminologi havde han ingen mulighed for at vide, om (–)-glyceraldehyd var (R) eller (S).mangler dette vigtige stykke information, valgte Fischer at gætte.,
gættet, som viste sig at være korrekt, var, at (–)-glyceraldehyd havde den konfiguration, vi nu kalder S, og at (+)-glyceraldehyd har den konfiguration, vi nu kalder R.
selvfølgelig var Cahn, Ingold og Prelog ikke født endnu, og CIP-systemet ville først blive udviklet efter Bijvoets arbejde i 1951. Så Fischer udviklede sin egen nomenklatur.
tegning glyceraldehyd i det, der senere ville blive kaldt Fischer –projektionen, tildelte han konfigurationen til venstre til (- ) – glyceraldehyd og kaldte det L – (forkortelse for Latin laevo )., Han tildelte derefter konfigurationen til højre til (+)-glyceraldehyd og kaldte den D- (for Latin de .tro ).
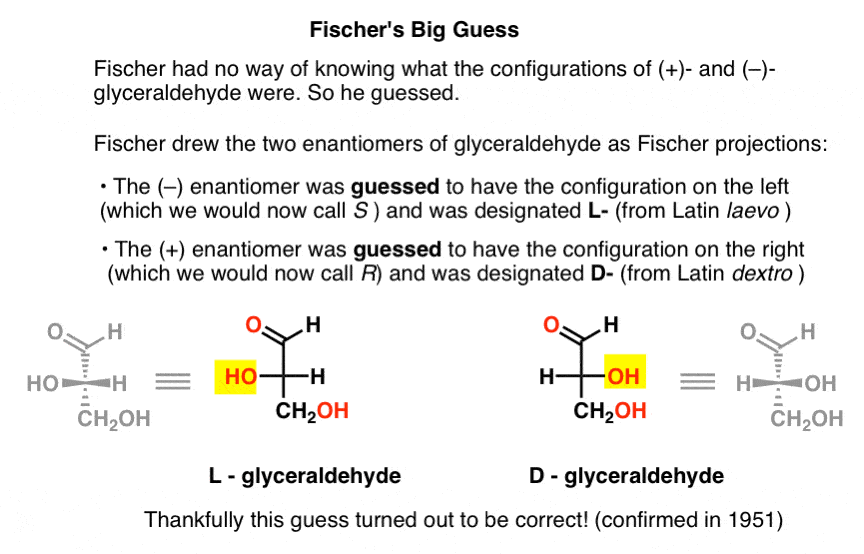
hvorfor er dette så vigtigt?
Tildeling af den absolutte konfiguration for L – og D – glyceraldehyde var lidt som at tildele Prime Meridian (0° længdegrad) til det Kongelige Observatorium i Greenwich, England., Ligesom længdegraden på ethvert andet sted på jorden derefter kunne bestemmes i forhold til dette punkt, hvis deres relative afstande var kendt, den absolutte konfiguration af hvert andet stereocenter kunne derefter bestemmes, hvis dens konfiguration i forhold til l – eller D – glyceraldehyd var kendt.
det er måske ikke den klareste analogi. Så lad os se på 4-carbon sukkerarter for et andet eksempel.,
fire Carbonaldehyd – D-og L-sukkerarter (Aldotetroser)
når de absolutte konfigurationer af L – og D – glyceraldehyd blev foreslået, kunne de absolutte konfigurationer af andre chirale forbindelser derefter etableres analogt (og meget kemisk gryntarbejde).
det er ikke afgørende for i dag, men for et eksempel på denne form for ræsonnement, se dette . tilbage, da begrebet chirale centre blev introduceret, lærte du sandsynligvis, at et molekyle med n chirale centre vil have 2n stereoisomerer (så længe der ikke er mesoforbindelser).,
Der er to aldoser med fire kulstof, threose og erythrose. De har hver to chirale centre. Hver findes som et par enantiomerer (l – og D -), der giver fire stereoisomerer i alt.
Her er de. Den vigtige ting at bemærke i figuren nedenfor er, at l-familien af sukkerarter har OH-gruppen af det nederste chirale kulstof til venstre, og D-familien har OH-gruppen af det nederste chirale kulstof til højre (fremhævet).,
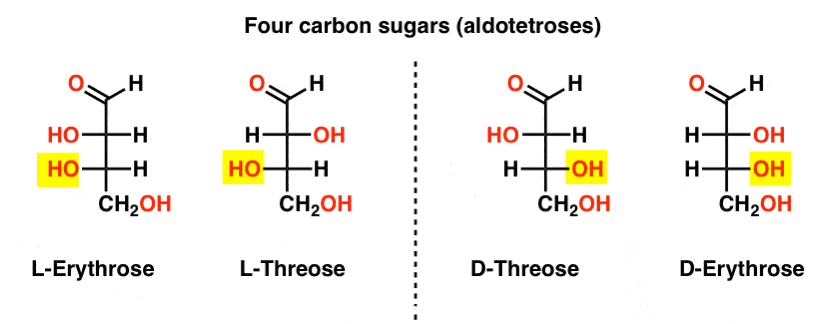
se hvordan L-Erythrose og L-Threose bygger på stereocenter etableret i L-glyceraldehyd (fremhævet), og D-Erythrose og D-Threose bygger på stereocenter etableret i D-glyceraldehyd (fremhævet).
sukkerarter er opbygget lidt som det binære system; du kan tænke på hver stereocenter er en “bit”, der kan have en af to værdier. Konfigurationen af L-erythrose og L-threose adskiller sig kun ved et stereocenter. Hvis vi skulle vende positionen af H og OH, vi ville få den anden., Dette forhold har et navn, som du måske ser nogle gange: to molekyler, der har den modsatte konfiguration på kun et stereocenter, kaldes epimere, især når et af atomerne, der er knyttet til stereocenteret, er et brint (h).
fem Carbonaldehyd – D – og L-sukkerarter (Aldopentoser)
det mest kendte navn på denne liste bør være ribose, som er sukkerrygraden i ribonukleinsyre (RNA).
på venstre side i diagrammet nedenfor har vi L-aldopentoserne, som alle deler den samme konfiguration af det nederste stereocenter, når aldehydet placeres øverst.,
deres enantiomerer, D-aldopentoserne, er på højre side, som alle deler den samme konfiguration af det nederste stereocenter (fremhævet).
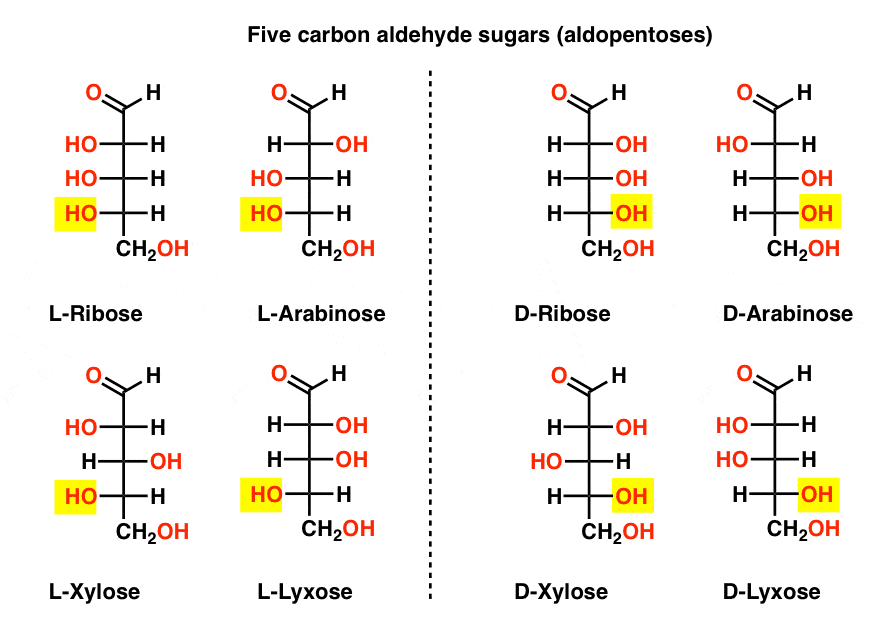
På dette tidspunkt skal vi påpege, at det overvældende flertal af sukkerarter i jordbaserede livsformer er D-sukkerarter, herunder D – ribose som rygraden i RNA. Hvorfor og hvordan alle organismer på jorden endte med D-sukker er et mysterium, som man antager, at L-sukker ville have fungeret lige så godt.,
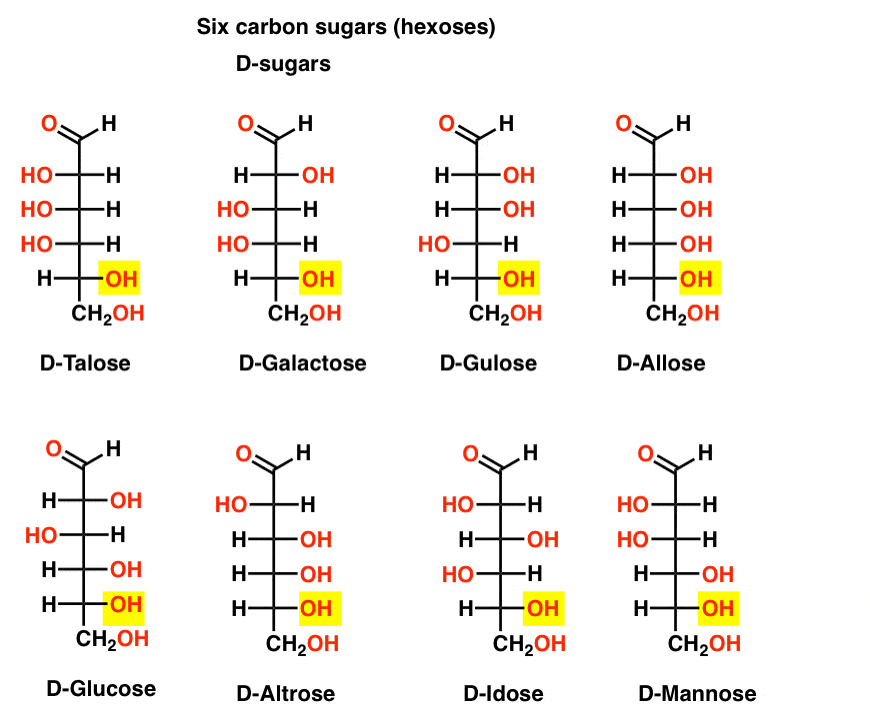
seks Carbonaldehyd-D – og L-sukkerarter (Aldohe ?oser)
Hvis der er 4 aldopentoser, hver som et D – L – par enantiomerer (8 stereoisomerer i alt), hvor mange aldohe ?oser er der så?
der er 8 D-L – par (16 stereoisomerer i alt). Den mest kendte er glukose, men du vil sandsynligvis genkende mannose og galactose. Nogle findes sjældent, hvis nogensinde, i naturen (idose, nogen?).
Her er D-aldohe .oses. Bemærk, hvordan de alle har den samme konfiguration af det nederste chiralcenter – den samme, som vi så I D-glyceraldehyd.,
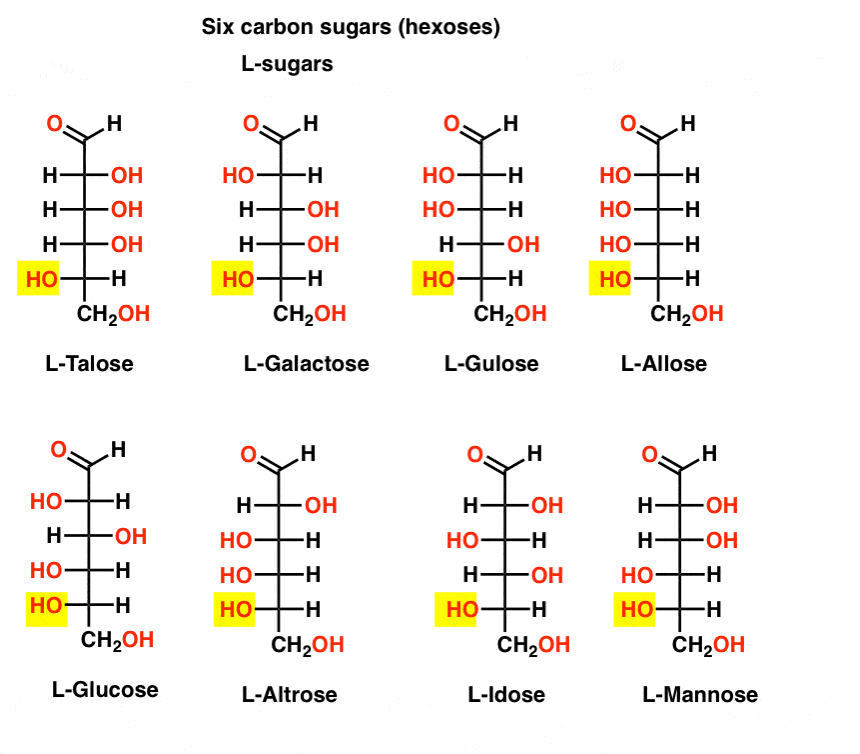
i modsætning til D-sukkeret findes l – sukkeret (nedenfor) sjældent i naturen. Interessant nok er L-glucose blevet udforsket som sukkerstatning. Dens smag kan ikke skelnes fra naturligt forekommende D-glucose, men giver ingen næring, da den ikke kan nedbrydes af vores (chirale) en .ymer. Da det viser sig, er produktionen bare for dyr til at konkurrere med splenda, stevia, aspartam et. al.
OK, det er nok. Syv-carbon sukker er blevet gjort (aldoheptoses), men de er ikke biologisk signifikant.,
7. Men vent-der er mere! (Aminosyrer)
Hvis du tegner aminosyrer i Fischer-projektion med den mest oxideret gruppe på top (carboxylsyre) så kan du også tildele L – og D-.
af de 19 chirale aminosyrer, der er inkorporeret i proteiner (proteinogen er det korrekte udtryk), er alle l- . (Glycin er achiral, så D-og L-gælder ikke). Nogle D-aminosyrer er naturligt forekommende, men de er sjældne (for det meste findes i bakterier, med den bemærkelsesværdige undtagelse af platypus gift) og er ikke kodet af mRNA.,
interessant nok, selvom alle 19 chirale aminosyrer er l- , er kun 18 af 19 (S). Hvad er undtagelsen?
(Dette er god organisk kemi bar trivia).
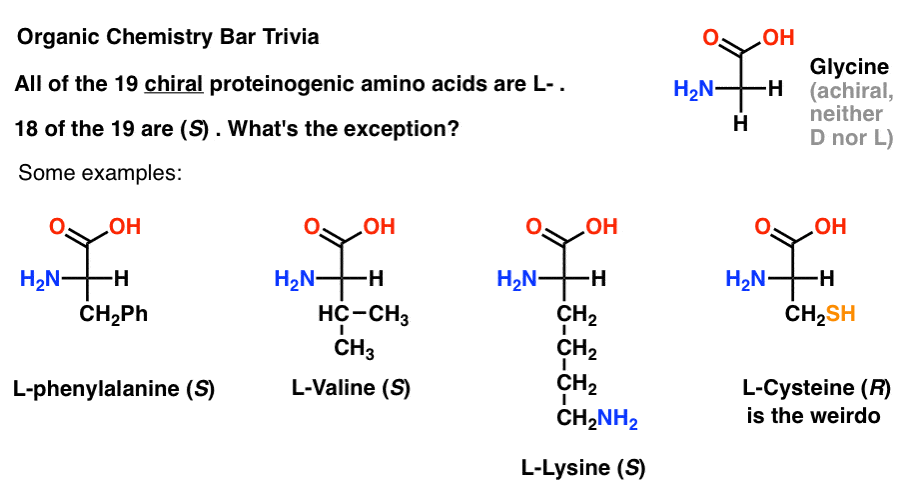
cystein er den underlige.
(bonuspoint, hvis du også sagde selenocystein … nørd).
resum.: D – og L – Notation for sukker og aminosyrer
så det er D – L – systemet til tildeling af absolut konfiguration. Det fungerer godt for sukkerarter, da de kan opbygges så systematisk (som det binære system). Det er også nyttigt for aminosyrer., Det centrale punkt er bare at se på det nederste stereocenter, mens det er tegnet i Fischer-projektionen. Ikke? D. Venstre? L.
naturligvis trækkes sukker ikke altid så hjælpsomt i Fischer – fremspring-de danner ringe. Vi skriver om bestemmelse af D – og L – i cykliske sukkerarter i et fremtidigt indlæg.
alt hvad jeg har at sige er, tak uanset hvilken guddom du vælger at tro på, at Fischers gæt viste sig at være korrekt. Det ville være en enorm smerte i røvet at Sile gennem 70+ år af den kemiske litteratur ved at vide, at den forkerte konfiguration var blevet tildelt alle sukkerarter og aminosyrer.,
tak til Thomas Struble for hjælp til dette indlæg.
noter
Note 1. “det næstsidste stereocenter i de fleste chirale sukkerarter er R, mens stereocenteret i de fleste aminosyrer er S” har ikke helt den samme ring, især da cystein er R. ]
Note. Her er et tankeeksperiment til bestemmelse af de relative konfigurationer af erythrose og threose., (Jeg siger “tankeeksperiment”, fordi jeg ikke ønsker at inkludere specifikke reagenser, som kan være distraherende)
Hvis man starter med ren (+)- erythrose og O .iderer den primære alkohol til et aldehyd ved hjælp af kendte metoder, opnår man en forbindelse, der mangler optisk rotation. Det samme gælder for (–)-erythrose, som returnerer en helt identisk forbindelse. Heraf kan det udledes, at strukturen af den nye forbindelse skal være sådan, at molekylet har et indre spejlplan (dvs.det er meso). .,
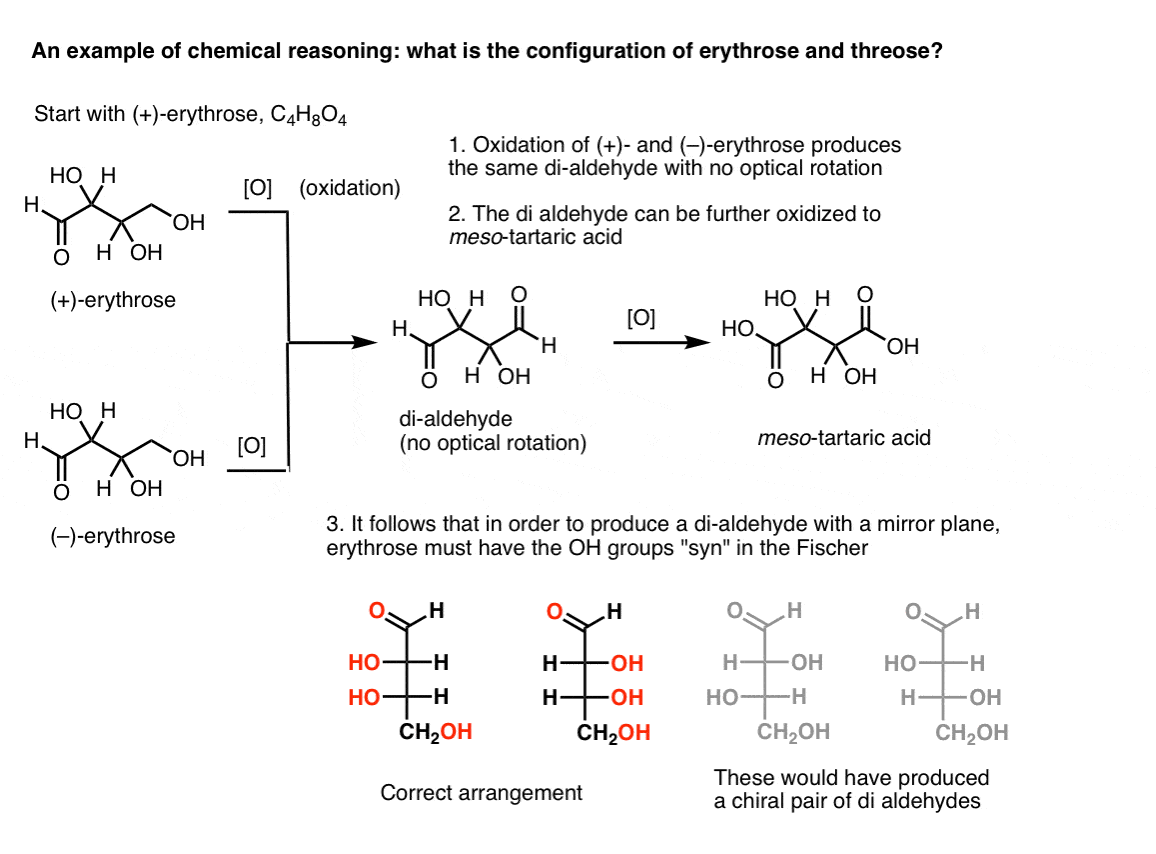
i modsætning hertil udfører den samme operation på (+)-threose et di-aldehyd, der opretholder optisk rotation. En forbindelse med lige og modsat optisk rotation dannes ved at udføre den samme operation på (–)-threose. Disse to forbindelser er enantiomerer. For at det skal være sandt, skal den relative orientering af hydro .ylgrupperne i threose være anti. Disse forbindelser kan o .ideres yderligere for at producere henholdsvis (–)- og (+)- vinsyre.,
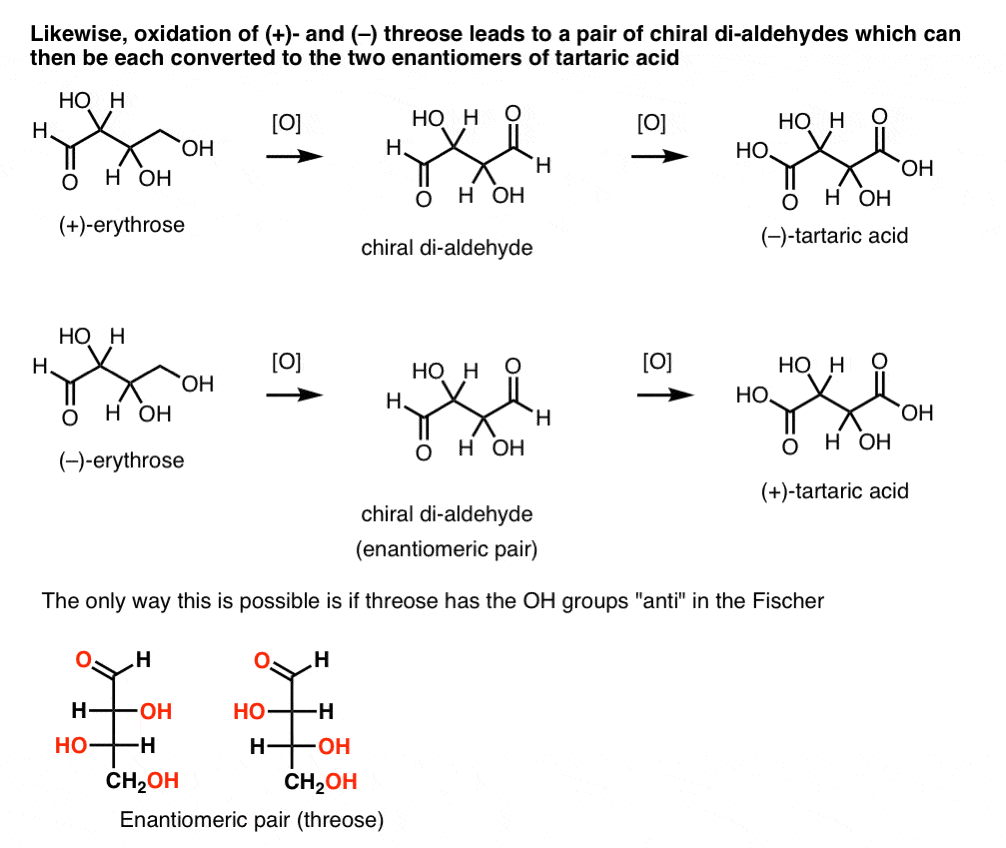
den samme begrundelse kan bruges i modsat retning (reduktion). For eksempel kan enten (+)- eller (–)- erythrose reduceres til tetra-ol erythritol, som er meso.
ligeledes resulterer reduktion af (+)- og (–) threose i et enantiomert par tetra-ols, threitol.
fra disse fakta kan vi udlede den relative orientering af OH-grupperne.
(avancerede) referencer og yderligere læsning
- Über die be .eichnung von optischen Antipoden durch die Buchstaben D und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002 / cber.19070400111
Dette er den berømte papir, hvor Prof. Emil Fischer (vilkårligt!) tildelt (-) – glyceraldehyd L-stereokemi. - synteser i purin-og sukkergruppen
Emil Fischer
Nobelforelæsning, 1902Fischers Nobelforelæsning, hvor han taler om sit arbejde ikke kun i kulhydrater, men også i puriner, hvoraf forbindelser som koffein og theobromin er medlemmer. Prof. Fisher forudsiger stigningen af energidrikke (f (, Red Bull) med angivelse af, “med udøvelsen af en lille fantasi kan dagen forudses, når bønner ikke længere kræves for at lave god kaffe: en lille mængde pulver fra et kemisk værk sammen med vand vil give en velsmagende, forfriskende drink overraskende billigt”.bestemmelse af den absolutte konfiguration af optisk aktive forbindelser ved hjælp af røntgenstråler
BIJVOET, J., PEERDEMAN, A. & van Bommel, A.,
Nature 1951, 168, 271-272
DOI: 1038/168271a0
det berømte papir, der ved hjælp af Røntgenstrukturanalyse beviste, at “Emil Fischers konvention, der tildelte konfigurationen af fig. 2 til detrtrorotatorisk syre, ser ud til at svare på virkeligheden”. - Emil Fischers opdagelse af glucosekonfigurationen. En semicentennial bakspejlet
C. S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
TO: 10.1021/ed018p353
En tidlig gennemgang, der dækker Prof. Emil Fischer ‘ s arbejde i kulhydrat kemi., - Emil Fischers bevis på konfigurationen af sukkerarter: en hundredeårig hyldest
Frieder Fri. Lichtenthaler
Ange.. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
En meget læsbar anmeldelse fra 1992, der dækker Prof. Fischers arbejde inden for kulhydratkemi og går dybt ind i de stereokemiske opgaver af kulhydrater.
