avant de répondre à la question, il est très important de comprendre ce qui se passe exactement du point de vue énergétique lorsque l’eau passe du liquide au solide.
disons que vous commencez à température ambiante. Lorsque les molécules d’eau sont en phase liquide, elles se déplacent constamment, se cognent et entrent en collision les unes avec les autres.
Les liaisons hydrogène sont toujours formées et brisées lorsque les molécules d’eau se déplacent les unes devant les autres.,
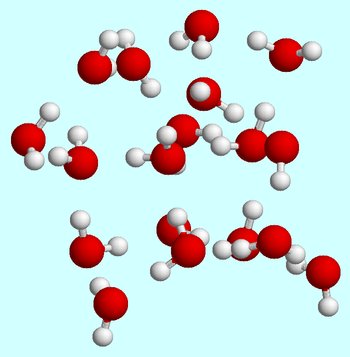
à température ambiante, l’état liquide est caractérisé par une énergie cinétique moyenne relativement élevée pour les molécules d’eau.
maintenant, afin de ralentir suffisamment ces molécules pour que les liaisons hydrogène qui se forment entre les molécules d’eau individuelles ne soient plus rompues, vous devez retirer de l’énergie du système.
lorsque l’eau est à l’état solide, les molécules sont « coincées » en position dans un réseau cristallin. L’énergie cinétique moyenne des molécules ne peut plus dominer les liaisons hydrogène, et de la glace se forme.,
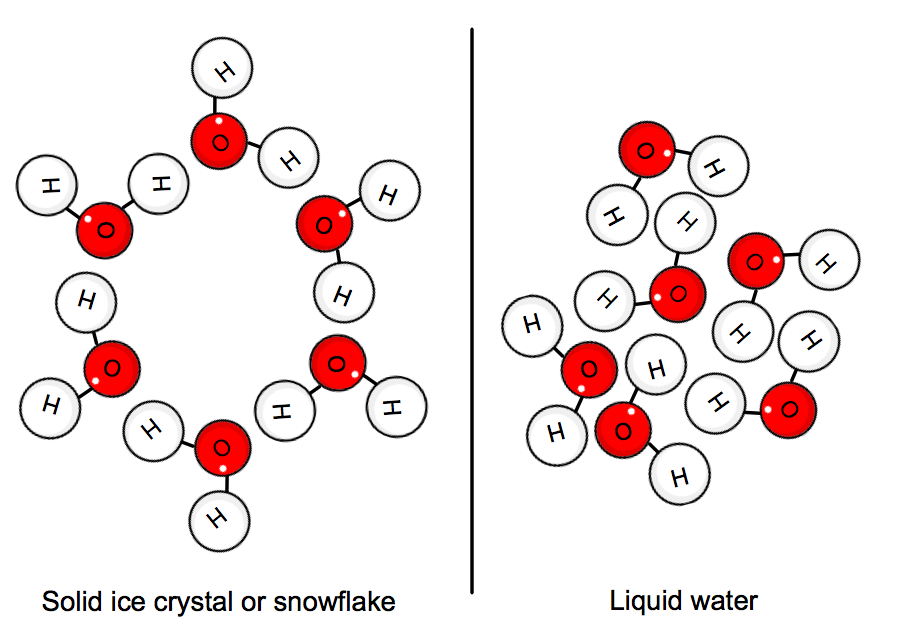
Cela implique que la chaleur doit être donné par le système, à savoir l’eau, afin de ralentir suffisamment pour que le cristal de forme.
en conséquence, le frézage de l’eau est un processus exothermique car la chaleur est évacuée du système.
Un processus endothermique impliquerait que la chaleur doit être fournie au système. Ce n’est clairement pas le cas ici, car fournir de la chaleur augmenterait en fait l’énergie cinétique moyenne des molécules d’eau.,
La fonte de la glace est un processus endothermique car vous devez fournir de la chaleur afin de permettre aux molécules de maîtriser les liaisons hydrogène et de recommencer à se déplacer.
