Prima di rispondere alla domanda, è molto importante capire cosa succede esattamente dal punto di vista energetico quando l’acqua passa da liquido a solido.
Diciamo che inizi a temperatura ambiente. Quando le molecole d’acqua si trovano nella fase liquida, si muovono costantemente, si urtano costantemente e si scontrano l’una con l’altra.
I legami idrogeno si formano e si rompono sempre mentre le molecole d’acqua si muovono l’una oltre l’altra.,
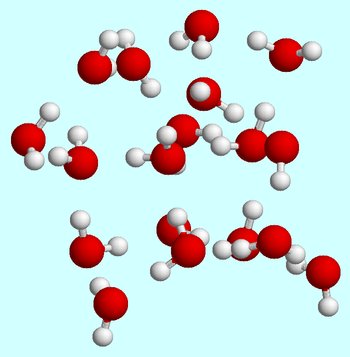
A temperatura ambiente, lo stato liquido è caratterizzato da un’energia cinetica media relativamente elevata per le molecole d’acqua.
Ora, per rallentare queste molecole abbastanza in modo che i legami idrogeno che si formano tra le singole molecole d’acqua non siano più rotti, è necessario estrarre energia dal sistema.
Quando l’acqua è allo stato solido, le molecole sono “bloccate” in posizione in una rete cristallina. L’energia cinetica media delle molecole non può più sopraffare i legami idrogeno, e così si forma il ghiaccio.,
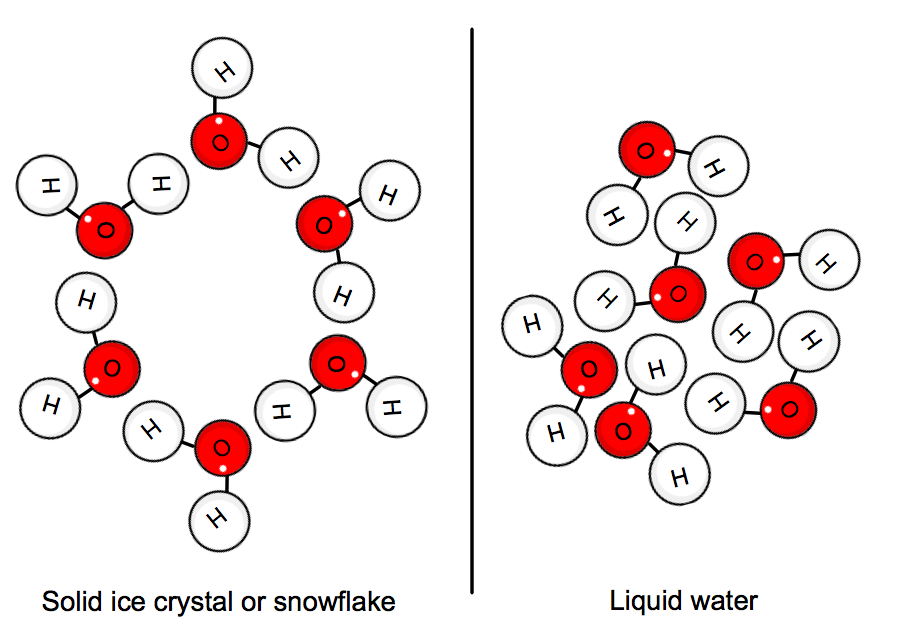
Ciò implica che il calore deve essere emesso dal sistema, cioè dall’acqua, per rallentare tutto abbastanza per formare il cristallo.
Come risultato, il congelamento dell’acqua è un processo esotermico perché il calore viene rimosso dal sistema.
Un processo endotermico implicherebbe che il calore deve essere fornito al sistema. Questo non è chiaramente il caso qui, dal momento che fornire calore aumenterebbe effettivamente l’energia cinetica media delle molecole d’acqua.,
Lo scioglimento del ghiaccio è un processo endotermico perché è necessario fornire calore per consentire alle molecole di sopraffare i legami idrogeno e ricominciare a muoversi.
