Stikstoftrifluoride chemische eigenschappen,Gebruik,productie
beschrijving
Stikstoftrifluoride is een kleurloos gas met weinig geur. Stikstof trifluoride is een oxidatiemiddel dat thennodynamisch stabiel is, behalve bij verhoogde temperaturen. Bij temperaturen tot ongeveer 482 ° F (250°C), is zijn reactiviteit vergelijkbaar met zuurstof. Bij hogere temperaturen, is zijn reactiviteit gelijkaardig aan fluor wegens merkbare dissociatie in NF2 en F-., De thennale dissociatie van stikstoftrifluoride is door een aantal onderzoekers bestudeerd en bleek een piek te vertonen in het temperatuurbereik van 1100K tot 1500K. bij de behandeling van stikstoftrifluoride moeten omstandigheden worden vermeden die kunnen leiden tot hoge temperaturen, zoals adiabatische compressie door de snelle druk van een systeem.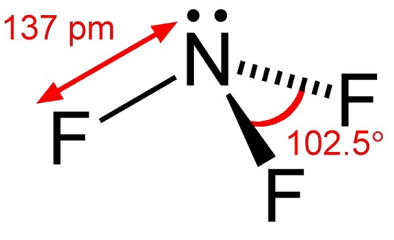
Stikstoftrifluoride werkt voornamelijk op de elementen als fluorinerend middel, maar niet erg actief bij lagere temperaturen., Bij verhoogde temperaturen pyrolyzeert stikstoftrifluoride met veel van de elementen om stikstoftetrafluoride en het overeenkomstige fluoride te produceren. De pyrolyse van stikstof trifluoride over koperdraaiingen produceert stikstof tetrafluoride in een 62 procent tot 71 procent opbrengst bij 707°F (375 ° C). Pyrolyse over koolstof is vollediger.
chemische eigenschappen
Stikstoftrifluoride is een kleurloos gas. Moldyodor. Verzonden als een niet-vloeibaar samengeperst gas.
fysische eigenschappen
kleurloos gas; beschimmelde geur; vloeibaar bij -128,75°C; Dichtheid van vloeistof 3.,116 g / mL; dampdruk bij -158°C 96 torr; stolt bij -206,8°C; kritische temperatuur -39,15°C; kritische druk 44,02 atm; kritisch volume 126 cm3/mol; zeer slecht oplosbaar in water.
gebruik
Stikstoftrifluoride is een etsmiddel en kamerreinigingsmiddel.oxidatiemiddel voor hoog-energetische brandstoffen, chemische synthese.
gebruik
Stikstoftrifluoride is een gas dat is gemaakt van stikstof-en fluor-atomen., De wereldwijde elektronica-industrie gebruikt stikstoftrifluoride in haar reinigingsprocessen, omdat het gas beter presteert dan andere alternatieven, gemakkelijker en veiliger te hanteren is en de uitstoot van broeikasgassen helpt verminderen.fabrikanten van halfgeleiders, dunne-filmzonnecellen en platte beeldschermen gebruiken stikstoftrifluoride om proceskamers te reinigen. In de kamers worden dunne lagen halfgeleidende en isolerende films aangebracht op wafers en panelen., Stikstof trifluoride verwijdert het residu dat deze films op de kamerwanden achterlaten, zodat de kamers efficiënt kunnen werken en een kwaliteitsapparaat kunnen produceren.
Stikstoftrifluoride biedt veel voordelen ten opzichte van alternatieve reinigingsmiddelen. Het is stabiel bij kamertemperatuur, dus het is relatief gemakkelijk en veilig te hanteren. Het is ook gemakkelijk om stikstof trifluoride te gebruiken om een energetisch, of reactief, gas of een plasma—een gas met vrije elektronen te vormen. De relatief lange levensduur van fluorradicalen in het plasma maakt van stikstoftrifluoride een efficiënte reiniger.,
gebruik
Stikstoftrifluoride is in grote hoeveelheden met succes gebruikt als fluorbron voor chemische lasers met hoge energie. Het heeft de voorkeur aan overfluormethaan vanwege het relatieve gebruiksgemak onder omgevingsomstandigheden.de laatste tijd wordt in de halfgeleiderindustrie steeds meer nitrogentrifluoride gebruikt als droog etsmiddel, met aanzienlijk hogere etssnelheden en selectiviteit in vergelijking met tetrafluorkoolstof en mengsels van koolstoftetrafluoride en zuurstof.,Stikstoftrifluoride werd begin jaren zestig ook gebruikt als oxidatiemiddel in raketten, maar deze toepassing werd niet op de markt gebracht.
preparaat
Stikstoftrifluoride wordt bereid door elektrolyse van gesmolten ammoniumfluoride, NH4F of gesmolten ammoniumzuurfluoride, NH4HF2 (of ammoniumfluoride in watervrij HF). Terwijl de nh4f-methode de voorkeur heeft omdat het stikstoftrifluoride vormt als het enige product, levert elektrolyse van ammoniumzuurfluoride een kleine hoeveelheid dinitrogeendifluoride, N2F2 en NF3 op.,
ook kan stikstoftrifluoride worden bereid door reactie van ammoniak met Fluor verdund met stikstof in een reactor vol koper. Andere stikstoffluoriden, zoals N2F2, N2F4 en NHF2 worden ook geproduceerd. De opbrengst van het belangrijkste product hangt af van de fluor/ammoniakverhouding en andere omstandigheden.
productiemethoden
Stikstoftrifluoride kan worden gevormd uit een grote verscheidenheid aan chemische reacties. Het commerciële productieproces omvat de directe fluorering van ammoniak met fluorgas in aanwezigheid van ammoniumfluoride.,
reacties
waterstof reageert met stikstoftrifluoride waarbij grote hoeveelheden warmte snel vrijkomen en vormt de basis voor het gebruik van stikstoftrifluoride in chemische lasers met hoge energie. Het ontvlambaarheidsbereik voor stikstof trifluoride-waterstofmengsels is 9,4 mol tot 95 mol procent stikstof trifluoride. Stikstof trifluoride reageert met organische verbindingen, maar over het algemeen is een verhoogde temperatuur nodig om de reactie in gang te zetten., Onder deze omstandigheden zal de reactie vaak explosief verlopen, en bij het blootstellen van stikstoftrifluoride aan organische verbindingen moet grote zorgvuldigheid worden betracht. Daarom heeft stikstoftrifluoride weinig gebruik gevonden Als fluorerend middel voor organische verbindingen.
algemene beschrijving
een kleurloos gas met een beschimmelde geur. Zeer vergiftig bij inademing. Moeilijk oplosbaar in water. Corrosief voor Weefsel. Bij langdurige blootstelling aan vuur of warmte kunnen de containers heftig scheuren en raket. Gebruikt om andere chemicaliën te maken en als onderdeel van raketbrandstoffen.,
lucht & Waterreacties
slecht oplosbaar in water.
Reactiviteitsprofiel
Stikstoftrifluoride is een zeer krachtig oxidatiemiddel. Gevaarlijk brandgevaar oplevert in aanwezigheid van reductiemiddelen. Etst glas in aanwezigheid van vocht. Geeft giftige en corrosieve dampen van fluoride wanneer verhit tot ontbinding . Kan heftig reageren met waterstof, ammoniak, koolmonoxide, diboraan, waterstofsulfide, methaan, tetrafluorhydrazine, houtskool. Explosieve reactie met chloordioxide., Bij blootstelling aan reducerende stoffen onder druk kan een ernstige explosie optreden .
gevaar
ernstig explosiegevaar. Corrosief voor Weefsel. Methemoglobinemie, lever-en nierschade.
gezondheidsrisico
het inademen van stikstoftrifluoride kan de capaciteit van rode bloedcellen om zuurstof te vervoeren verminderen. Dit veroorzaakt cyanose, of een blauwachtige verkleuring van de huid. Het inademen van stikstoftrifluoride kan ook leiden tot hoofdpijn, duizeligheid, zwakte en verwarring., Na langdurige blootstelling aan hoge concentraties kunnen afbraak van rode bloedcellen en veranderingen in de lever, nieren, milt en hartspier optreden als secundaire effecten. In de frisse lucht, de eerste rode bloedcellen veranderingen zal duidelijk over enkele uren, maar de persoon moet nog steeds worden gecontroleerd op secundaire effecten.
brandgevaar
stof verbrandt niet, maar ondersteunt de verbranding. Sommigen kunnen explosief reageren met brandstoffen. Kan brandbare stoffen (hout, papier, olie, kleding, enz.). Dampen uit vloeibaar gas zijn aanvankelijk zwaarder dan lucht en verspreiden zich over de grond., Runoff kan brand of explosiegevaar veroorzaken. Containers kunnen exploderen bij verhitting. Gescheurde cilinders kunnen raket.
industrieel gebruik
Stikstoftrifluoride is met succes in grote hoeveelheden gebruikt als fluorbron voor hoog-energetische chemische lasers. Het heeft de voorkeur boven fluor vanwege zijn relatieve gebruiksgemak bij omgevingsomstandigheden.,de laatste tijd wordt in de halfgeleiderindustrie steeds meer stikstoftrifluoride gebruikt als droog etsmiddel, met aanzienlijk hogere etssnelheden en selectiviteit in vergelijking met Tetrafluoride en mengsels van Tetrafluoride en zuurstof.
Stikstoftrifluoride werd ook gebruikt als oxidator in raketten in de vroege jaren 1960, maar deze toepassing werd niet gecommercialiseerd.
materialen gebruiken
bij temperaturen lager dan 250°C, stikstoftrifluoride heeft een reactiviteit die vergelijkbaar is met die van zuurstof en is relatief inert voor de meeste bouwmaterialen., Bij omgevingstemperaturen kunnen messing, aluminium, koper, staal, en roestvrije stalen worden gebruikt omdat corrosietarieven van minder dan 0,1 mil/Jr. bij 160 ° F (71.1°C) zijn bepaald voor deze materialen. Stikstoftrifluoride is ook compatibel met Gefluoreerde materialen zoals vlon bij omgevingstemperatuur temperatures.At verhoogde temperaturen en druk, reactiviteit stikstof trifluoride stijgt steeds meer als die van fluor, met nikkel enmonel de voorkeur materialen van de bouw.
veiligheidsprofiel
een gif. Licht giftig bij inademing., Langdurige absorptie kan leiden tot mottling van tanden, skeletveranderingen.Ernstige explosiegevaar door chemische reactie met reducerende stoffen, met name wanneer onder druk. Een zeer gevaarlijk brandgevaar; een zeer krachtige oxidator; anderwiseinert bij normale temperaturen en drukken.
potentiële blootstelling
dit materiaal is gebruikt in de chemische synthese en als oxidatiemiddel voor brandstoffen met een hoog energieniveau (als oxidatiemiddel in combinaties van raketstuwingsmiddelen).
fysiologische effecten
ACGIH beveelt een Waardegrenswaarde-Tijdgewogen gemiddelde (TLV-TWA) aan van 10 ppm (29 mgim3) voor stikstoftrifluoride., De tl-TWA is de tijdgewogen gemiddelde concentratie voor een nietnale werkdag van 8 uur en een werkweek van 40 uur, waaraan bijna alle werknemers dag na dag herhaaldelijk, zonder nadelige gevolgen, kunnen worden blootgesteld.
OSHA geeft een acht uur Tijdgewogen gemiddelde toelaatbare blootstellingslimiet (TWA-PEL) van 10 ppm (29 mg/m3) voor stikstoftrifluoride.TWA-PEL is de blootstellingslimiet die niet mag worden overschreden door de 8-urige Twain om het even welke 8-urige ploegendienst van een 40-urige werkweek.,de toxiciteit van stikstoftrifluoride is gerelateerd aan zijn vermogen tot fonn methemoglobine, een gemodificeerde Fonn van hemoglobine die niet in staat is om zuurstof te vervoeren, en om rode bloedcellen(hemolyse) te vernietigen. Na stopzetting van de blootstelling keert methemoglobine spontaan terug naar hemoglobine. Bij hoge blootstellingsniveaus kan therapeutische interventie echter noodzakelijk zijn (zuurstof,methyleenblauw, wisseltransfusie). Het optreden van hemolyse vereist zorgvuldige controle op de mate van bloedarmoede en het potentieel voor een verminderde nierfunctie.,de TLV-TWA-waarde van 10 ppm van Stikstoftrifluoride was het resultaat van een studie waarbij ratten gedurende 7 uur per dag, 5 dagen per week gedurende 18 maanden tot 100 ppm werden blootgesteld. Er werden geen veranderingen gedetecteerd in het gedrag van de dieren, hart-of longsnelheden, bloedniveaus of het verschijnen van fluorose. ACGIH stelde de TLV-TWA op III 0 van het testniveau.gasvormige stikstoftrifluoride wordt beschouwd als onschadelijk voor de huid en een licht irriterend voor de ogen en de slijmvliezen.
opslag
stikstoftrifluoridecilinders moeten tijdens het gebruik stevig worden ondersteund om beweging en overbelasting van verbindingen te voorkomen., Volledige cilinders moeten worden opgeslagen in een goed geventileerde ruimte, beschermd tegen overmatige hitte (51,7°C), buiten organische of ontvlambare materialen geplaatst en beveiligd. Afsluiterbeschermkappen en afsluiterdoppen moeten te allen tijde veilig op hun plaats zijn wanneer de cilinder niet in gebruik is.
verzending
UN2451 Stikstoftrifluoride, gevarenklasse: 2.2; etiketten: 2.2-niet-ontvlambaar gecomprimeerd gas; 5.1-oxidator.De cilinders moeten in een veilige, rechtopstaande positie worden vervoerd, in een goed geventileerde vrachtwagen. Bescherm cilinder en etiketten tegen fysieke schade., De eigenaar van de gecomprimeerde gasfles is de enige entiteit die volgens de federale wet (49CFR) is toegestaan om ze te vervoeren en bij te vullen. Het is een overtreding van de vervoersvoorschriften om gecomprimeerde gasflessen te vullen zonder de uitdrukkelijke schriftelijke toestemming van de eigenaar.
Toxiciteitsevaluatie
de toxiciteit van stikstoftrifluoride is gerelateerd aan zijn vermogen tot fonn methemoglobine, een gemodificeerde fonn van hemoglobine die niet in staat is tot zuurstoftransport, en tot het vernietigen van rode bloedcellen (hemolyse). Na stopzetting van de blootstelling keert methemoglobine spontaan terug naar hemoglobine., Bij hoge blootstellingsniveaus kan therapeutische interventie echter noodzakelijk zijn (zuurstof, methyleenblauw, wisseltransfusie). Het optreden van hemolyse vereist zorgvuldige controle op de mate van bloedarmoede en het potentieel voor verminderde nierfunctie.
onverenigbaarheden
het gas is een krachtige oxidator. Presenteert gevaarlijk brandgevaar in aanwezigheid van reductiemiddelen. Etst glas in aanwezigheid van vocht., Reageert metolie, vet, reductiemiddelen en andere oxideerbare materialen; brandbare stoffen, organische stoffen, ammoniak,koolmonoxide; methaan, waterstof,waterstofsulfide; actieve kool; diboraan, water. Kan heftig reageren met waterstof, ammoniak, koolmonoxide, diboraan, waterstofsulfide, methaan,tetrafluorhydrazine, houtskool. Stikstoftrifluoride zal de intensiteit van een bestaande brand verhogen.
afvalverwijdering
retourneer navulbare drukgascilinders naar de leverancier., Vent in groot volume concentraatreducerende agent (bisulfieten, ferrozouten of hypo)oplossing, dan neutraliseren en spoelen naar het riool met grote volumes water.
beschikbare kwaliteiten
Stikstoftrifluoride is beschikbaar in kwaliteiten variërend van 98% tot 99,995% V / vminimumzuiverheid.
