Outras Séries
\
Os valores de \(n_2\) e número de \(\widetilde{\nu}\) para esta série seria:
você sabe em que região da radiação eletromagnética estas linhas são? É claro que estas linhas estão na região UV, e não são visíveis, mas são detectadas por instrumentos; estas linhas formam uma série Lyman., As existências da série Lyman e da série Balmer sugerem a existência de mais séries. Por exemplo, a série com \(n_2 = 3\) e \(n_1\) = 4, 5, 6, 7, … chama-se Pashen series.
Vários série
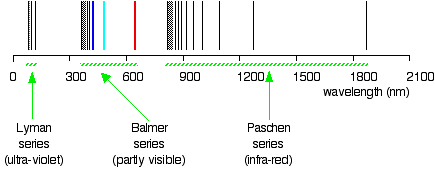
exemplo \(\PageIndex{1}\): A série Lyman
a chamada série Lyman de linhas no espectro de emissão de hidrogênio corresponde a transições de vários estados excitados para a órbita n = 1. Calcule o comprimento de onda da linha de menor energia da série Lyman para três figuras significativas. Em que Região do espectro eletromagnético ocorre?,
Dado: mais baixa energia da órbita da série de Lyman
Perguntado: comprimento de onda de menor energia Lyman linha e região correspondente do espectro
a Estratégia:
Solução:
podemos usar a equação de Rydberg (Equação \ref{1.5.1}) para calcular o comprimento de onda:
\
Um Para a série de Lyman, \(n_1 = 1\).Espectroscopistas frequentemente falam sobre energia e frequência como equivalentes. A unidade cm – 1 (wavenumbers) é particularmente conveniente. Podemos converter a resposta em parte A Para cm-1.,
E
\
Esta linha de emissão é chamada Lyman alpha e é a mais forte linha de emissão atômica do sol e impulsiona a química da atmosfera superior de todos os planetas que produzem íons, removendo elétrons de átomos e moléculas. Ele é completamente absorvido pelo oxigênio na estratosfera superior, dissociando moléculas de O2 a átomos de O que reagem com outras moléculas de O2 para formar ozônio estratosférico
B Este comprimento de onda está na região ultravioleta do espectro.,
exercício \(\PageIndex{1}\): A série de Pfund
a série de Pfund de linhas no espectro de emissão de hidrogénio corresponde a transições de estados excitados mais elevados para o \(n_1 = 5\). Calcular o comprimento de onda da segunda linha da série Pfund para três algarismos significativos. Em que Região do espectro se encontra?
Resposta
\(4.65 \times 10^3\ nm\); infravermelho
A discussão acima apresenta apenas uma descrição fenomenológica de hidrogênio linhas de emissão e não fornecer uma sonda da natureza do átomo em si., Claramente um modelo contínuo baseado na mecânica clássica não é aplicável, e como a próxima seção demonstra, uma conexão simples entre espectros e estrutura atômica pode ser formulada.
