Introdução
infecções Nosocomiais causadas por multidroga resistente Acinetobacter baumannii estão se tornando cada vez mais comuns em todo o mundo, especialmente no tratamento intensivo definição (Wieland et al., 2018). O sucesso desta bactéria é facilitado pela sua capacidade de sobreviver em uma variedade de ambientes, agravada pela sua rápida capacidade de adquirir resistência multi-drogas. Os hidratos de carbono superficiais desempenham papéis-chave na aptidão geral e virulência de A., baumannii (Lees-Miller et al., 2013; Geisinger and Isberg, 2015; Weber et al., 2016). A. baumannii produz polissacárido capsular de elevada massa molecular (CPS) que envolve a membrana externa (Figura 1) (Russo et al., 2010). Composta por subunidades de oligossacáridos repetitivos (unidades K), o CPS forma uma camada discreta na superfície bacteriana, proporcionando proteção de diversas condições ambientais, ajudando na evasão das defesas imunitárias do hospedeiro, e aumentando a resistência a um número de compostos antimicrobianos (Russo et al., 2010; Iwashkiw et al., 2012; Geisinger e Isberg, 2015).,
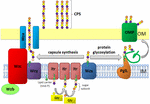
a Figura 1. Representação esquemática da montagem e exportação de polissacáridos da cápsula em A. baumannii. A síntese começa com a transferase inicial (Itr; maroon) localizada na membrana interna (IM) transferindo o primeiro açúcar da unidade de repetição para um portador lipídico (Und-P; círculo verde). Os açúcares subsequentes são então adicionados à unidade de crescimento por glicosiltransferases específicas (Gtr; amarelo) no lado citosólico da membrana interna., A subunidade da cápsula (unidade K) é então transferida para o periplasma através da proteína integral da membrana Wzx (azul escuro). As subunidades de açúcar são polimerizadas pela proteína Wzy (púrpura) e o complexo Wza/Wzb/Wzc (ciano, cal, vermelho) coordena a polimerização de alto nível e a exportação da cadeia de crescimento, movendo-os para a membrana exterior (OM). Para a glicosilação, PglL (laranja) liga as unidades K às proteínas seleccionadas da membrana exterior (OMP; verde-escuro).
In A. baumannii, capsule assembly and export occurs via a Wzy-dependent pathway (Hu et al.,, 2013; Kenyon and Hall, 2013; Willis and Whitfield, 2013; Woodward and Naismith, 2016) (Figura 1). Tipicamente consistindo de 4-6 açúcares, a unidade K é montada na molécula portadora de lípidos undecaprenil pirofosfato (Und-P), que fornece um suporte para a cadeia de açúcar em crescimento (Whitfield, 2006). O primeiro açúcar na unidade K é recrutado por uma transferase inicial ligada à membrana interna (IM), seguida pela adição sequencial de açúcares à unidade K em crescimento por enzimas específicas de glicosil transferase (Gtr) (Figura 1) (Woodward e Naismith, 2016)., Cada unidade K é então transferida para o lado periplásmico do IM pela translocase Wzx e polimerizada por Wzy, que transfere a cadeia crescente de polissacáridos de um portador Und-P para a subunidade seguinte (figura 1) (Collins et al., 2007). Após a síntese do polímero CPS, é transportado para a superfície celular através de um processo altamente coordenado envolvendo a interação de três proteínas; Wza, Wzb e Wzc, que compõem a máquina de exportação (Figura 1)., A síntese de CPS representa um braço de uma via bifurcada, uma vez que estas unidades K também são usadas para decorar certas proteínas superficiais através da glicosilação proteica o-ligada (Lees-Miller et al., 2013). Neste caso, as unidades K únicas são transferidas para as proteínas receptoras pela O-oligossacchariltransferase PglL (Figura 1) (Iwashkiw et al., 2012). In A. baumannii, protein glycosylation contributes to biofilm formation by enhancing initial attachment and maturation of biofilms, and pathogenicity as demonstrated in a number of animal infection models (Iwashkiw et al., 2012; Scott et al., 2014; Harding et al.,, 2015). Biofilm é um estado de crescimento no qual comunidades bacterianas estão fechadas dentro de uma matriz de exopolissacarídeos e tem sido mostrado para desempenhar um papel significativo na persistência e resistência de A. baumannii.outros hidratos de carbono superficiais conhecidos por influenciarem a patogenicidade de A. baumannii incluem a lipooligossacarida (LOS) e o exopolissacarídeo poli-β-(1-6)-N-acetilglucosamina (PNAG) (Preston et al., 1996; Weber et al., 2016). A PNAG forma a “cola” coesa dos biofilmes e constitui uma proporção substancial de biofilmes (Choi et al., 2009; Longo et al., 2014)., Ao contrário da maioria das bactérias gram-negativas, A. baumannii não produz lipopolissacarídeo tradicional, mas sim um glicojugato de superfície similar, LOS, composto por um lípido um núcleo que carece de o antígeno (Kenyon e Hall, 2013; Kenyon et al., 2014b). A perda da produção de LOS em A. baumannii diminui a estabilidade da membrana externa levando a uma redução da aptidão (Moffatt et al., 2010; Beceiro et al., 2014).embora muitas moléculas de hidratos de carbono influenciem a patogenicidade, pode argumentar-se que a EPC é um factor de virulência predominante de A. baumannii. Esta revisão visa consolidar o que é conhecido sobre A., baumannii capsule including selected structures, biosynthesis and gene organization, the role of CPS in virulence, and the potential for CPS as a target for future vaccine and drug development.à medida que os genomas completos de mais isolados de A. baumannii se tornam disponíveis, A verdadeira diversidade das estruturas das cápsulas presentes dentro desta bactéria está se tornando aparente. Até à data, foram identificados mais de 100 loci de cápsula única (KL) em A. baumannii (figura 2A) (Shashkov et al., 2017). Estas regiões tipicamente variam de 20 a 35 kb em tamanho., A análise dos genes que orientam a síntese de CPS em dez genomas A. baumannii resultou originalmente na designação de nove tipos de cápsulas, KL1-KL9, que se tornou a base para um esquema de Digitação universal para estes loci (Kenyon e Hall, 2013). Este regime foi posteriormente alargado para ter em conta a identificação de novos K loci. A localização cromossómica do locus K, entre os genes fkpA e lldP, é altamente conservada entre estirpes A. baumannii e contém os genes necessários para a biossíntese e exportação específicos para cada tipo de CPS (Figura 2) (Hu e al.,, 2013; Kenyon and Hall, 2013). Uma exceção a esta regra são as estirpes A. baumannii possuindo regiões de KL19 e KL39, onde o gene que codifica a polimerase Wzy, wzy, é encontrado em uma pequena ilha genética em outras partes do cromossomo (Kenyon et al., 2016a). Além disso, os genes necessários para alguns dos açúcares comuns vistos em CPS são encontrados em outros lugares., Tudo K loci mostrar um semelhante genética de configuração, altamente variável cluster de síntese e transferase genes necessários para a biossíntese de única KL-tipo de complexo de açúcares, ladeada de um lado pelo altamente conservadas CPS exportação de genes, e por outro lado por um conjunto de genes de codificação conservada açúcares simples e precursores (Figura 2A)., Os genes wzx e wzy necessários para o processamento de unidades repetidas são altamente variáveis entre K loci (figura 2A, azul claro), indicando especificidade para estruturas particulares de unidades K e, em geral, a ordem dos determinantes gtr, codificando glicosiltransferases específicas nas regiões KL, corresponde inversamente à ordem de Acção.
, 2015; Kenyon et al.,, 2015). Além disso, adicionando à sua diversidade, várias regiões KL contêm genes redundantes que não são necessários para a síntese da unidade K final. Por exemplo, KL8 e KL9 contêm dois genes itr (Kenyon e Hall, 2013) e KL37 tem a fosfogliceroltransferase pgt1, mas nenhum resíduo de fosfoglicerol correspondente na estrutura determinada (Arbatsky et al., 2015). Além disso, em KL93, dois elementos da sequência de inserção (Isabela26 e Isabela22) interrompem o determinante pgt1 (Figura 2) (Kasimova et al., 2017)., Os genes necessários para a biossíntese específica do açúcar não serão discutidos, uma vez que estas vias já foram cobertas anteriormente e estão além do âmbito desta revisão (Hu et al., 2013; Kenyon and Hall, 2013). Além disso, outros genes localizados dentro do KL codificam produtos que se prevê estarem envolvidos na acetilação ou modificação da acilação de glicanos específicos (figura 2A, rosa). Embora o exame do K loci possa revelar muito sobre as estruturas da unidade K, é necessária análise química e testes bioquímicos para determinar estruturas exatas e identificar ligações específicas entre açúcares repetidos.,
CPS Estruturas
Os primeiros estudos sobre CPS serotyping de A. baumannii foram impulsionados pela necessidade de desenvolver um método para discriminar A. baumannii isolados de outras espécies Acinetobacter, como análise fenotípica foi castigada com a ambiguidade e a falta de identificação (Traub, 1989). Como descrito acima, há uma diversidade fenomenal vista em A. baumannii clusters de genes de biossíntese, que se traduz na diversidade vista na estrutura de unidade K (Hu et al., 2013; Kenyon and Hall, 2013). Coletivamente, mais de 40 a., as estruturas unitárias de baumannii K foram elucidadas até agora usando espectroscopia NMR e análise química. K as estruturas unitárias diferem na composição do açúcar. Podem incluir derivados de açúcares comuns ligados à UDP, tais como glucose, galactose e ácido glucurónico ou açúcares atípicos, tais como ácidos não-2-ulosónicos. As estruturas variam em comprimento e podem consistir de apenas dois resíduos, como visto para o tipo K53 CPS (Shashkov et al., 2018), ou até cinco ou seis monossacáridos, como o referido na figura 2B (Arbatsky et al., 2015)., As estruturas também diferem nas ligações dentro e entre unidades K resultando na produção de unidades K que são lineares ou envolvem ramos laterais, como visto em K1 e K93, respectivamente (figura 2B) (Kenyon et al., 2016a; Kasimova et al., 2017). As diferenças na localização de ligações glicosídicas específicas e os padrões de o-acetilação de vários oligossacáridos dentro de uma estrutura também contribuem para a diversidade da unidade K.,
a variação entre as estruturas da unidade K pode ser sutil, por exemplo, K12 e K13 diferem apenas pela ligação de dois glicanos, o que requer o uso de uma polimerase Wzy alternativa; consequentemente, o loci K de ambas as estirpes são idênticos, exceto para o gene wzy (Figura 2). Alternativamente, a variação pode ser impressionante, como a incorporação de açúcares raros, incluindo derivados do ácido pseudamínico, legionamínico ou acinetamínico, conforme visto nas estruturas K2/6, K49 e K12/13, respectivamente (Figura 2) (Kenyon et al., 2014a, 2015; Vinogradov et al., 2014; Kasimova et al., 2018)., Curiosamente, os derivados do ácido acinetamínico só foram identificados em A. baumannii e não são encontrados em nenhum outro lugar na natureza (Kenyon et al., 2017). Adicionalmente, algumas unidades K incorporam derivados únicos de glicanos específicos, por exemplo o ácido pseudamínico de K93 é acetilado com um grupo (R)-3-hidroxibutanoílo (Kasimova et al., 2017), enquanto que em K2 e K6 o ácido pseudamínico não é acetilado (Figura 2)., Além disso, a estrutura de K4 é sem igual, pois contém apenas aminosugars, D-QuipNAc, e de um terminal de N-acetil-D-galactosamine (D-GalpNAcA) ramo que é tampada com um pyruvyl grupo, um raro motivo e o primeiro a ser descrito em Acinetobacter (Figura 2A, preto) (Kenyon et al., 2016b). À medida que aumenta o número de estruturas de unidade K elucidadas, aumenta a confiança para inferir a estrutura de unidade K a partir da análise dos aglomerados de biossíntese posicionados no A. baumannii KL., No entanto, embora informativo, uma compreensão do papel que o CPS desempenha na patogênese é importante para aplicar este conhecimento para melhorar os resultados das infecções por A. baumannii.
papel na virulência, resistência antimicrobiana e persistência
é inquestionável que a presença de SPC é essencial para a patogenicidade de A. baumannii. Não só é necessário para evitar as defesas imunitárias do hospedeiro (Russo et al., 2010; Geisinger e Isberg, 2015), mas é importante para a resistência aos compostos antimicrobianos e sobrevivência em ambientes adversos (Luke et al., 2010; Russo et al.,, 2010; Geisinger e Isberg, 2015). O CPS mediata a evasão imunológica em muitas estirpes de A. baumannii, limitando as interações entre as estruturas de superfície imunogênicas das bactérias e as defesas hospedeiras (Preston et al., 1996; Wu et al., 2009; Russo et al., 2010; Umland et al., 2012; Lees-Miller et al., 2013; Geisinger e Isberg, 2015; Wang-Lin et al., 2017). A abolição da cápsula em múltiplas estirpes de A. baumannii mostrou uma sobrevivência reduzida no soro humano e fluido ascite, e atenuação em modelos de infecção de ratos e murinos (Russo et al., 2010; Umland et al., 2012; Lees-Miller et al.,, 2013; Sanchez-Larrayoz et al., 2017). Além disso, a regulação da produção de cápsulas na comumente utilizada estirpe A. baumannii ATCC 17978 (tipo de CPS K3) aumentou a resistência sérica e virulência em um modelo de infecção do rato (Geisinger e Isberg, 2015). Além disso, novos tratamentos antimicrobianos poderiam ser desenvolvidos para tipos específicos de CPS, por exemplo os que contêm ácido pseudamínico, uma vez que a sua presença tem sido correlacionada com virulência aumentada (Hitchen et al., 2010; Kao et al., 2016).além da protecção contra as defesas do hospedeiro, em A., a produção de CPS baumannii aumenta a resistência a uma gama de compostos antimicrobianos, incluindo os utilizados para desinfecção em ambientes clínicos (Geisinger e Isberg, 2015; Tipton et al., 2015; Chen et al., 2017). Além disso, o crescimento de A. baumannii em níveis sub-inibitórios de antimicrobianos influencia a produção de CPS. Por exemplo, a exposição a antibióticos cloranfenicol eritromicina levou ao reforço da cápsula síntese ATCC 17978 (Geisinger e Isberg, 2015) e meropenem exposição selecionada para mutações levando a uma perda de CPS de produção no isolar 37662 (Chen et al., 2017)., Estudos realizados numa gama mais vasta de estirpes de A. baumannii são necessários para identificar se a protecção contra os antimicrobianos proporcionada pelo CPS é específica da estirpe, específica do tipo cápsula ou universal.a capacidade de A. baumannii persistir no ambiente clínico aumentou indubitavelmente a colonização e infecções em doentes susceptíveis. A. baumannii é capaz de sobreviver por meses em superfícies hospitalares, tais como trilhos de cama, móveis e dispositivos médicos, fornecendo um reservatório que é muitas vezes a fonte de transmissão e infecção (Wendt et al., 1997; Gayoso et al., 2013)., O notável tolerância a dessecação de A. baumannii é pensado para ser devido a um “busto ou lança” estratégia, onde um persistente subpopulação de células sobrevivem à custa de morrer células; CPS aumenta a tolerância a dessecação, fornecendo uma barreira física facilitando a retenção de água (Roberts, 1996; Webster et al., 2000; Gayoso et al., 2013; Bravo et al., 2016). Um papel direto para o CPS na resistência à dessecação foi recentemente demonstrado na estirpe A. baumannii AB5075 (Tipo K25 CPS). Neste estudo, a variante acapsular do AB5075 apresentou um 2.,Redução da viabilidade 5 vezes superior à estirpe parental (Tipton et al., 2018). Além disso, em dois parentes próximos de A. baumannii, Acinetobacter calcoaceticus e Acinetobacter baylyi, a produção de exopolysaccharide e/ou CPS tem sido mostrado para promover a secagem de sobrevivência (Roberson e Firestone, 1992; Ophir e Gutnick, 1994). Além de influenciar a resistência à dessecação, o CPS tem sido associado a outros traços de virulência, incluindo motilidade (McQueary et al., 2012; Huang et al., 2014) e a produção de biofilm (Umland et al., 2012; Lees-Miller et al.,, 2013), cimentando assim o seu papel como fator patogênico.estudos recentes relacionaram o fenótipo variável de fase de A. baumannii AB5075 com alterações na produção de SPC, uma vez que variantes opacas altamente virulentas produzem uma camada de SPC com o dobro da espessura das suas contrapartes translúcidas (Chin et al., 2018). Esta transição de translúcida para opaca também aumentou drasticamente o potencial patogênico de A. baumannii AB5075. A resistência a desinfectantes hospitalares comuns e a um subconjunto de antibióticos aminoglicósidos também aumentou (Tipton et al., 2015; Chin et al., As variantes opacas também eram mais resistentes à lisozima humana, ao peptídeo antimicrobiano relacionado com a catelicidina LL37 e ao peróxido de hidrogénio em comparação com colónias translúcidas (Chin et al., 2018). Além disso, os isolados opacos tiveram uma maior tolerância às condições dessecadas e contrapartes translúcidas fora da competição num modelo de infecção do rato (Chin et al., 2018). Como vários fatores estão envolvidos na variação de fase, foram realizados outros estudos para determinar a contribuição da produção de CPS para o fenótipo opaco mais virulento., Numa publicação subsequente, os autores demonstraram que uma variante acapsular era significativamente mais susceptível à lisozima e aos desinfectantes, em comparação com o seu progenitor opaco AB5075 de tipo selvagem (Tipton et al., 2018). Curiosamente, não houve diferença na resistência ao LL-37 e peróxido de hidrogénio entre as estirpes opacas de tipo selvagem e acapsular, sugerindo que outros factores para além da produção de SPC levam a este fenótipo para variantes opacas de A. baumannii (Tipton et al., 2018).,
regulação da produção de CPS
sugestões ambientais, tais como temperatura, pressão osmótica e alterações no metabolito e disponibilidade iónica, podem influenciar a produção de CPS bacteriana (Hagiwara et al., 2003; Lai et al., 2003; Mouslim et al., 2004; Willenborg et al., 2011). Não é surpreendente que tenham sido identificados poucos mecanismos regulamentares para a produção de CPS, uma vez que os níveis de CPS são geralmente regulados pós-translacionalmente através da fosforilação de máquinas de exportação de CPS (Whitfield and Paiment, 2003; Chiang et al., 2017). Em A., baumannii, apenas dois reguladores da produção de cápsulas foram identificados até agora; BfmRS e OmpR-EnvZ, ambos dois sistemas componentes de transdução de sinais que desempenham múltiplos papéis regulatórios envolvidos na biogênese de envelope (Geisinger e Isberg, 2015; Tipton e Rather, 2017; Geisinger et al., 2018). Quando submetido a pressão antibiótica, A. baumannii ATCC 17978 EPS expressão foi aumentada de forma dependente de BfmRS (Geisinger e Isberg, 2015). A variação de fase, e, portanto, potencialmente produção de CPS, é altamente regulada pelo sistema OmpR-EnvZ em A., baumannii AB5075, as mutations in either OmpR or EnvZ resulted in a significant increase in opaque to translucent switching frequency (Tipton and Rather, 2017). Embora a transição da translúcida para a opaca resulte num aumento de duas vezes na espessura da cápsula, as análises transcriptómicas não identificaram quaisquer diferenças nos níveis de expressão dos genes KL entre as duas fases.
CPS como alvo para o desenvolvimento de vacinas e tratamentos contra A. baumannii
antibiótico (especificamente cabapenem) resistente A., baumannii são classificados como um organismo crítico da Organização Mundial de saúde prioritário 1 para o desenvolvimento de novos antimicrobianos (OMS, 2017). Embora não existam tratamentos não-antibióticos ou vacinas licenciadas para A. baumannii atualmente, há um maior interesse em seu desenvolvimento e estudos preliminares parecem promissores. A exposição à superfície e a prevalência em estirpes patogénicas de A. baumannii tornam a CPS um alvo ideal para tratamentos antimicrobianos e vacinas (Russo et al., 2013)., Estes incluem o desenvolvimento de terapias à base de anticorpos, tais como vacinas profiláticas, imunização passiva e terapia de fagos (García-Quintanilla et al., 2013).
vários estudos demonstraram a eficácia da imunização passiva em ratinhos utilizando um anticorpo específico da CPS, que é protector contra a provocação bacteriana com 13-55% dos isolados clínicos de A. baumannii (Russo et al., 2013; Yang et al., 2017; Lee et al., 2018)., Além disso, a inoculação com vacinas conjugadas que incorporam glicanos EPC ligados a um portador de proteínas provoca uma melhor protecção imunitária do que a CPS purificada contra uma gama diversificada de estirpes de A. baumannii (Yang et al., 2017).
O interesse na terapêutica de fagina para o tratamento de infecções bacterianas aumentou nos últimos anos em resposta à actual crise de resistência antimicrobiana crescente. A terapia de FAG é atraente como uma potencial via de tratamento para infecções por A. baumannii multidrug resistentes., Por exemplo, uma FAG que codificou uma DESPOLIMERASE SPC foi encontrada para degradar o SPC de aproximadamente 10%, quatro em 38, clínica multidrug resistente A. baumannii testado (Hernandez-Morales et al., 2018). Embora a gama de hospedeiros desta praga seja limitada, ela pode ser incorporada como parte de um coquetel de phage para maximizar a eficácia ou focalizar surtos específicos (Hernandez-Morales et al., 2018). Uma praga que separa selectivamente a ligação de A., baumannii CPS em um ramo de ácido pseudamínico pode ser valioso para a terapia de FAG, ou para o fabrico eficiente de CPS purificado para o desenvolvimento de vacinas e anticorpos (Lee et al., 2018). Recentemente, verificou-se que os fagos destinados a A. baumannii eram estáveis quando impregnados em produtos para tratamento de feridas de queimadura sob uma série de condições, incluindo na presença de antimicrobianos (Merabishvili et al., 2017). No entanto, como a maioria dos estudos investigando A. baumannii CPS são geralmente confinados a uma determinada estirpe A. baumannii, não se sabe se estes achados se traduzem em todos A., isolados de baumannii ou se forem específicos do tipo de estirpe ou cápsula. Compreender o papel que a cápsula desempenha em múltiplas estirpes é fundamental na identificação de tipos de CPS que representam os melhores alvos para novas vacinas, ou se o desenvolvimento de agentes antimicrobianos que visam a via de biossíntese da cápsula é, de facto, até viável.embora a cápsula represente uma característica importante de virulência de A. baumannii, existem poucos dados disponíveis sobre o papel que os diferentes tipos de CPS desempenham na causa da doença., Para desenvolver vacinas e terapias eficazes visando a CPS, devemos primeiro obter uma compreensão abrangente para os mecanismos por trás de sua síntese e expressão, juntamente com as vantagens que a cápsula transmite para as bactérias hospedeiras. Esta investigação deve ser abordada no contexto da extrema variação dos serótipos de CPS encontrados em A. baumannii, a fim de assegurar o trabalho de potenciais intervenções contra estirpes que produzem diversas estruturas de CPS., São necessários mais estudos sobre o CPS para fornecer uma plataforma para o desenvolvimento de medidas preventivas e tratamentos contra este patógeno humano cada vez mais persistente e mortal.
Autor Contributions
JS wrote the first draft. MB forneceu dados acadêmicos e revisão crítica do artigo. FA produziu alinhamentos do genoma e forneceu revisão crítica do manuscrito. Todos os autores aprovaram a versão final.
financiamento
Este trabalho foi apoiado por uma subvenção da Fundação de Investigação Médica Flinders à MB. FA foi apoiado por AJ E IM Naylon e Playford Trust Ph. D., Bolsa. JS foi apoiado por uma AJ E IM Naylon Scholarship.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Traub, W. H. (1989). Serotipagem de Acinetobacter baumannii para delinear surtos de infecção cruzada nosocomial. J. Clin. Microbiol. 27, 2713–2716.
PubMed Abstract | Google Scholar
Whitfield, C., and Paiment, A. (2003)., Biossíntese e montagem de polissacáridos capsulares do grupo 1 em Escherichia coli e polissacáridos extracelulares conexos noutras bactérias. Carboidratos. Res. 338, 2491-2502. doi: 10.1016 / j. carres.2003.08.010
PubMed Abstract | CrossRef Full Text/Google Scholar
WHO (2017). Lista de prioridades globais de bactérias resistentes a antibióticos para orientar a pesquisa, descoberta e desenvolvimento de novos antibióticos. Genebra: Organização Mundial De Saúde.
Google Scholar
