exemplo – previsão da polaridade Molecular:
Decidewheter as moléculas representadas pelas seguintes fórmulas são ornonpolares polares. (Você pode precisar desenhar estruturas de Lewis e esboços geométricos para doso.)
um. CO2 b. DE2 c. CCl4 d. CH2Cl2 e. HCN
Solução:
um. A estrutura de Lewis do CO2 é
O electronegativities de carbono e oxygenare 2.55 e 3.44. Zero.,89 diferença na eletronegatividade indica que as ligações c-o são polares, mas o arranjo simétrico dessas ligações torna a molécula não-polar.se colocarmos setas no sketch geométrico do CO2, vemos que elas se equilibram exatamente, tanto na direção quanto na magnitude. Isto mostra a simetria das ligações.
b., A estrutura de Lewis para DE2 é
O electronegativities de oxigênio e flúor,3.44 e 3.98, respectivamente, produzir um 0.54 diferença que nos leva a predictthat o De títulos são polares. A geometria molecular de OF2 é curvada. A distribuição assimétrica de ligações polares de Suchan produziria uma molécula polar.
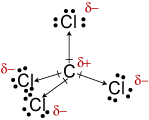
c. A geometria molecular de CCl4 istetrahedral., Embora as ligações C-Cl sejam polares, as suas disposições simétricas transformam a molécula não-polar.
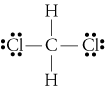
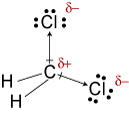
d. TheLewis estrutura para CH2Cl2 é
O electronegativities de hidrogênio, carbono, andchlorine são 2.20, 2.55, e 3.16. A diferença de 0,35 na eletronegatividade das ligações H-C nos diz que elas são essencialmente não-polares. Zero.,61diferença na eletronegatividade para as ligações C-Cl mostra que elas são polares. Os seguintes esboços geométricos mostram que as ligações polares estão dispostas de forma areasimétrica, de modo que a molécula é polar. (Note que a estrutura de Lewisstructure acima sugere incorretamente que as ligações são simetricamente dispostas.Tenha em mente que estruturas de Lewis muitas vezes dão uma falsa impressão da geometria das moléculas que representam.)

e., TheLewis estrutura e desenho geométrico para o HCN são os mesmos:
O electronegativities de hidrogênio,carbono e nitrogênio são 2.20, 2.55, e 3.04. A diferença de 0,35 na eletronegatividade para a ligação H-C mostra que ela é essencialmente não-polar. A diferença de 0,49 na eletronegatividade para a ligação C-N nos diz que é polar.Moléculas com uma ligação polar são sempre polares.