trifluoreto de Azoto Química,Propriedades,Usos, Produção
Descrição
trifluoreto de Azoto é um gás incolor, com pouco odor. Trifluoreto de nitrogênio é um oxidante que é thennodynamicamente estável, exceto em temperaturas elevadas. A temperaturas até 482 ° F (250 ° C), sua reatividade é comparável ao oxigênio. A temperaturas mais elevadas, a sua reactividade é semelhante ao flúor devido a uma dissociação apreciável em NF2 E F -., O thennal dissociação de trifluoreto de azoto, tem sido estudada por diversos pesquisadores e tem sido encontrado para o pico na faixa de temperatura de 1100K a 1500K. Na manipulação de trifluoreto de azoto, condições deve ser evitado que podem resultar em altas temperaturas, tais como compressão adiabática da rápida pressurização do sistema.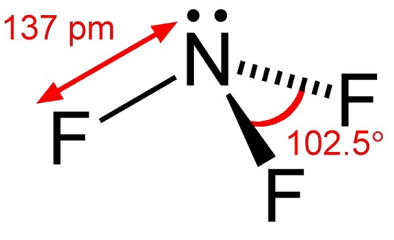
trifluoreto de nitrogênio atua principalmente sobre os elementos como um agente fluorinante, mas não muito ativo a temperaturas mais baixas., A temperaturas elevadas, trifluoreto de nitrogênio pirolyzes com muitos dos elementos para produzir tetrafluoreto de nitrogênio e o fluoreto correspondente. The pyrolysis of nitrogen trifluoride over copper turnings produces nitrogen tetrafluoride in a 62 percent to 71 percent yield at 707 ° F (375°c). A pirólise sobre o carbono é mais completa. o trifluoreto de nitrogênio é um gás incolor. Moldyodor. Enviado como um gás comprimido não liquidado.
propriedades físicas
gás incolor; odor a mofo; liquefeitos a -128,75 ° C; Densidade do líquido 3.,116 g / mL; pressão de vapor a -158°C 96 torr; solidifica a -206.8°C; temperatura crítica -39.15 ° C; Pressão crítica 44.02 atm; volume crítico 126 cm3/mol; muito ligeiramente solúvel em água. o trifluoreto de azoto é um agente de limpeza de câmara e de decantação.oxidante para combustíveis de alta energia, síntese química. o trifluoreto de nitrogênio é um gás que é feito de átomos de nitrogênio e flúor., A indústria eletrônica global usa trifluoreto de nitrogênio em seus processos de limpeza, porque o gás supera outras alternativas, é mais fácil e mais seguro de manusear, e ajuda a reduzir as emissões de gases de efeito estufa.fabricantes de semicondutores, células solares de película fina e painéis planos usam trifluoreto de nitrogênio para limpar câmaras de processo. No interior das câmaras, as camadas finas de semicondutores e películas isolantes são aplicadas a bolachas (wafers) e painéis., Trifluoreto de nitrogênio remove o resíduo que estes filmes deixam nas paredes da câmara para que as câmaras possam operar de forma eficiente e produzir um dispositivo de qualidade.trifluoreto de nitrogênio oferece muitos benefícios sobre agentes de limpeza alternativos. É estável à temperatura ambiente, por isso é relativamente fácil e seguro de manusear. Também é fácil usar trifluoreto de nitrogênio para formar um gás energético, ou reativo, ou um plasma—um gás com elétrons livres. A vida relativamente longa dos radicais de flúor feitos no plasma faz do trifluoreto de nitrogênio um limpador eficiente., o trifluoreto de azoto tem sido utilizado com sucesso em grandes quantidades como fonte de flúor para lasers químicos de alta energia. É preferida a overfluorina devido à sua facilidade comparativa de manuseio em condições ambientes.
recentemente, uma quantidade crescente de nitrogentrifluoreto está sendo usado na indústria de semicondutores como um etchant seco, mostrando taxas de etch significativamente mais elevadas e seletividades quando comparado com tetrafluoreto de carbono e misturas de tetrafluoreto de carbono e oxigênio.,o trifluoreto de nitrogênio também foi usado como oxidante em foguetes no início da década de 1960, mas esta aplicação não foi comercializada. o trifluoreto de azoto é preparado por electrólise de fluoreto de amónio fundido, NH4F ou fluoreto de ácido de amónio fundido, NH4HF2 (ou fluoreto de amónio em HF anidro). Enquanto o método NH4F é preferido porque forma trifluoreto de nitrogênio como o único produto, a eletrólise do fluoreto de ácido de amônio produz uma pequena quantidade de Difluoreto de dinitrogênio, N2F2 e NF3.,também, trifluoreto de nitrogênio pode ser preparado por reação de amônia com flúor diluído com nitrogênio em um reator embalado com cobre. Outros fluoretos de nitrogênio, como N2F2, N2F4 e NHF2 também são produzidos. O rendimento do produto principal depende da razão flúor/amoníaco e de outras condições. os métodos de produção de trifluoreto de azoto podem ser formados a partir de uma grande variedade de reacções químicas. O processo comercial de produção envolve a fluorinação directa de amoníaco com gás flúor na presença de fluoreto de amónio., o hidrogênio reage com trifluoreto de nitrogênio com a rápida libertação de grandes quantidades de calor e é a base para o uso de trifluoreto de nitrogênio em lasers químicos de alta energia. O intervalo de inflamabilidade para misturas de trifluoreto de nitrogênio-hidrogênio é de 9,4 mole por cento a 95 mole por cento trifluoreto de nitrogênio. Trifluoreto de nitrogênio reage com compostos orgânicos, mas geralmente uma temperatura elevada é necessária para iniciar a reação., Sob estas condições, a reação muitas vezes vai prosseguir explosivamente, e grande cuidado deve ser exercido ao expor o trifluoreto de nitrogênio a compostos orgânicos. Portanto, o trifluoreto de nitrogênio tem encontrado pouco uso como um agente fluorinante para compostos orgânicos.
Descrição geral
Um gás incolor com odor a mofo. Muito tóxico por inalação. Ligeiramente solúvel em água. Corrosivo ao tecido. Sob exposição prolongada a fogo ou calor, os recipientes podem romper violentamente e foguete. Usado para fazer outros produtos químicos e como um componente de combustíveis de foguetes.,
ar& reacções à água
ligeiramente solúveis em água. o trifluoreto de azoto é um agente oxidante muito poderoso. Apresenta perigo de incêndio perigoso na presença de agentes redutores. Grava vidro na presença de humidade. Emite fumos tóxicos e corrosivos de fluoreto quando aquecidos para decomposição . Pode reagir violentamente com hidrogénio, amónia, monóxido de carbono, diborano, sulfureto de hidrogénio, metano, tetrafluorohidrazina, carvão vegetal. Reacção explosiva com dióxido de cloro., Pode ocorrer uma explosão grave quando exposta a agentes redutores sob pressão . perigo de explosão grave. Corrosivo ao tecido. Metemoglobinemia, lesão hepática e renal. o trifluoreto de azoto inalado pode reduzir a capacidade dos glóbulos vermelhos transportarem oxigénio. Isto causa cianose, ou uma descoloração azulada da pele. Trifluoreto de nitrogênio respiratório também pode levar a dor de cabeça, tonturas, fraqueza e confusão., Após exposição prolongada a concentrações elevadas, a degradação dos glóbulos vermelhos e as alterações no fígado, rins, baço e músculo cardíaco podem ocorrer como efeitos secundários. No ar fresco, as alterações iniciais dos glóbulos vermelhos irão desaparecer durante várias horas, mas a pessoa ainda deve ser monitorizada para efeitos secundários. a substância não queima, mas suporta a combustão. Alguns podem reagir explosivamente com combustíveis. Pode inflamar combustíveis (madeira, papel, óleo, vestuário, etc.). Os vapores do gás liquefeito são inicialmente mais pesados que o ar e se espalham ao longo do solo., O escoamento pode criar risco de incêndio ou explosão. Os recipientes podem explodir quando aquecidos. Os cilindros rompidos podem explodir. o trifluoreto de nitrogênio tem sido usado com sucesso em grandes quantidades como fonte de flúor para lasers químicos de alta energia. É preferido ao flúor devido à sua facilidade comparativa de manuseamento em condições ambientes.,recentemente, uma quantidade crescente de trifluoreto de nitrogênio está sendo usado na indústria de semicondutores como um etchante seco, mostrando taxas de etch significativamente mais altas e selectividade quando comparado com tetrafluoreto de carbono e misturas de tetrafluoreto de carbono e oxigênio.trifluoreto de nitrogênio também foi usado como oxidante em foguetes no início dos anos 1960, mas esta aplicação não foi comercializada. a temperatura inferior a 482°F (250°C), o trifluoreto de azoto tem uma reactividade semelhante à do oxigénio e é relativamente inerte para a maioria dos materiais de construção., À temperatura ambiente, latão, alumínio, cobre, aço e aços inoxidáveis podem ser usados porque taxas de corrosão inferiores a 0,1 mil/ano. a 160°F (71,1°c) foram determinados para estes materiais. O trifluoreto de azoto é também compatível com materiais fluorados como o asTeflon no ambiente. temperatures.At altas temperaturas e pressões, a reatividade do trifluoreto de nitrogênio aumenta tornando-se mais parecida com a do flúor, com níquel e monel sendo os materiais preferidos de construção.
perfil de segurança
um veneno. Ligeiramente tóxico por inalação., A absorção prolongada pode provocar alterações nos dentes e no esqueleto.Perigo de explosão grave por acção química com agentes redutores, em especial quando sob pressão. Um perigo de incêndio muito perigoso; um oxidante muito poderoso; outros são inertes a temperaturas e pressões normais.
exposição potencial
este material tem sido utilizado na quimiicalíntese e como oxidante para combustíveis de alta energia (Asan oxidante em combinações de propulsores de foguetes).
efeitos fisiológicos
ACGIH recomenda uma média ponderada pelo valor-limite (TLV-TWA) de 10ppm (29 mgim3) para o trifluoreto de azoto., A BTV-TWA é a concentração média ponderada no tempo para um dia de trabalho não Diário de 8 horas e uma semana de trabalho de 40 horas, à qual quase todos os trabalhadores podem ser repetidamente expostos, dia após dia, sem efeitos adversos.
OSHA lists an 8-hour Time-Weighted Average-Pennmissible Exposure Limit (TWA-PEL)of 10 ppm (29 mg/m3) for nitrogen trifluoride.O TWA-PEL é o limite de exposição que não deve ser excedido em 8 horas por cada turno de 8 horas de trabalho de uma semana de trabalho de 40 horas.,a toxicidade do trifluoreto de nitrogênio é relacionada à sua capacidade de fonn metemoglobina, um fonn modificado da hemoglobina incapaz de oxigentransport, e para destruir os glóbulos vermelhos(hemólise). Após a cessação da exposição, a meta-hemoglobina reverte espontaneamente para a hemoglobina. No entanto, a níveis elevados de exposição,pode ser necessária intervenção terapêutica (oxigénio, azul de metileno, transfusão de permuta). A ocorrência de hemólise requer monitorização cuidadosa do grau de anemia e do potencial para a função renal emparelhada.,o valor TLV-TWA de 10ppm do trifluoreto de nitrogênio resultou de um estudo que expôs ratos a 100 ppm durante 7 horas por dia, 5 dias por semana durante 18 meses. Não foram detectadas alterações nos comportamentos dos animais, na frequência cardíaca ou pulmonar, nos níveis sanguíneos ou no aparecimento de fluorose. O ACGIH fixou o TLV-TWA no nível III 0 do ensaio.o trifluoreto de nitrogênio gasoso é considerado inócuo para a pele e um pouco irritante para os olhos e membranas mucosas. os cilindros de trifluoreto de azoto devem ser armazenados de forma segura durante a sua utilização, para evitar o movimento e o esforço das ligações., Os cilindros completos devem ser armazenados numa área bem ventilada, protegida do calor excessivo (125°F ou 51.7°c), localizada longe de materiais orgânicos ou inflamáveis e fixada. As tampas de protecção das válvulas e as tampas de saída das válvulas devem estar sempre seguras quando o cilindro não estiver a ser utilizado.
expedição
trifluoreto de azoto UN2451, Classe de perigo: 2.2; rótulos: 2.2-gás comprimido não inflamável; 5.1-oxidante.Os cilindros devem ser transportados numa posição vertical segura, num camião bem ventilado. Proteger o cilindro e os rótulos dos danos físicos., O proprietário do cilindro de gás comprimido é a única entidade autorizada pela lei federal (49CFR) a transportá-los e recarregá-los. É uma violação das regras de transporte reabastecer cilindros de gás comprimido sem a expressa autorização por escrito do proprietário. a toxicidade do trifluoreto de nitrogênio está relacionada à sua capacidade de fonn metemoglobina, um fonn modificado da hemoglobina incapaz de transporte de oxigênio, e para destruir os glóbulos vermelhos (hemólise). Após a cessação da exposição, a meta-hemoglobina reverte espontaneamente para a hemoglobina., No entanto, a níveis elevados de exposição, pode ser necessária intervenção terapêutica (oxigénio, azul de metileno, transfusão de permuta). A ocorrência de hemólise requer monitorização cuidadosa do grau de anemia e do potencial para Compromisso da função renal.
incompatibilidades
o gás é um oxidante poderoso. Apresenta riscos de incêndio perigosos na presença de agentes redutores. Grava vidro na presença de humidade., Reage com óleo, gordura, agentes redutores e outros materiais oxidáveis;combustíveis, orgânicos, amônia, monóxido de carbono; metano,hidrogênio, sulfeto de hidrogênio; carvão ativado; diborano,água. Pode reagir violentamente com hidrogénio, amónia,monóxido de carbono, diborano, sulfureto de hidrogénio, metano, tetrafluorohidrazina,carvão vegetal. O trifluoreto de azoto aumentará a intensidade de um incêndio existente. eliminação de resíduos de cilindros de gás de compressão Recarregáveis ao fornecedor., Expire para um grande volume de agente redutor concentrado (bissulfitos, sais ferrosos ou hipo), neutralize e lave para os esgotos com grandes vapores de água. o trifluoreto de azoto está disponível em graus que variam entre 98% e 99.995% de pureza v/vminimum.
