antes de responder a la pregunta, es muy importante entender qué sucede exactamente desde el punto de vista energético cuando el agua pasa de líquido a sólido.
digamos que empiezas a temperatura ambiente. Cuando las moléculas de agua están en la fase líquida, se mueven constantemente, chocan y chocan entre sí.
los enlaces de hidrógeno siempre se forman y rompen a medida que las moléculas de agua se mueven entre sí.,
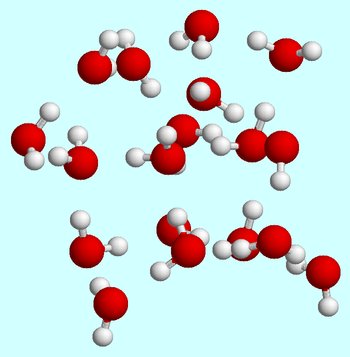
a temperatura ambiente, el estado líquido se caracteriza por una energía cinética media relativamente alta para las moléculas de agua.
ahora, con el fin de ralentizar estas moléculas lo suficiente para que los enlaces de hidrógeno que se forman entre las moléculas de agua individuales ya no se rompen, es necesario tomar energía fuera del sistema.
Cuando el agua está en su estado sólido, las moléculas se «atascan» en su posición en una red cristalina. La energía cinética promedio de las moléculas ya no puede dominar los enlaces de hidrógeno, y así se forma hielo.,
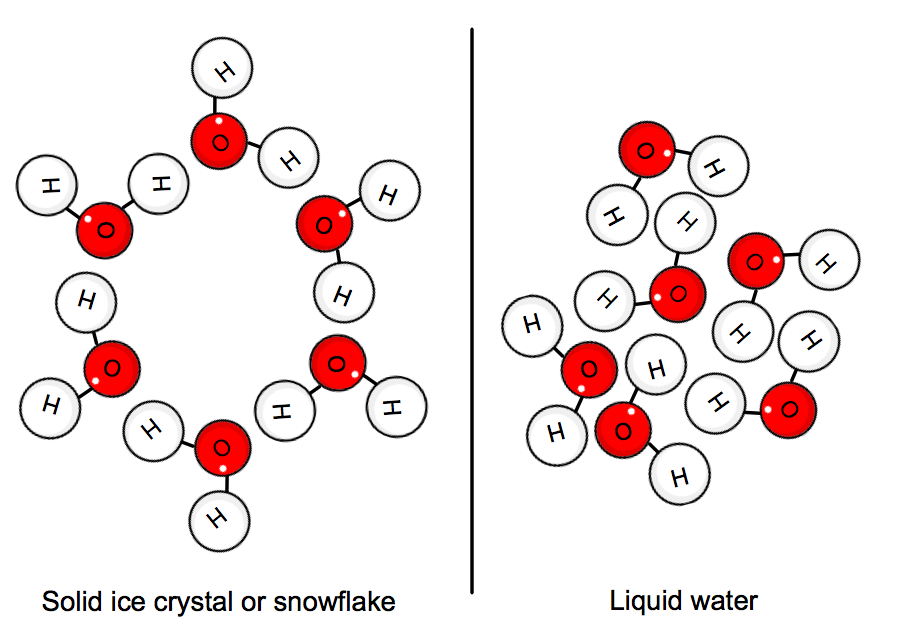
esto implica que el calor debe ser emitido por el sistema, es decir, el agua, con el fin de ralentizar todo lo suficiente para que el cristal se forme.
como resultado, el frezing del agua es un proceso exotérmico porque el calor se está eliminando del sistema.
un proceso endotérmico implicaría que se debe suministrar calor al sistema. Claramente no es el caso aquí, ya que proporcionar calor en realidad aumentaría la energía cinética promedio de las moléculas de agua.,
derretir el hielo es un proceso endotérmico porque necesitas proporcionar calor para permitir que las moléculas dominen los enlaces de hidrógeno y comiencen a moverse de nuevo.
