Vor der Beantwortung der Frage ist es sehr wichtig zu verstehen, was genau aus energetischer Sicht passiert, wenn Wasser von flüssig zu fest wird.
Nehmen wir an, Sie beginnen bei Raumtemperatur. Wenn sich Wassermoleküle in der flüssigen Phase befinden, bewegen sie sich ständig, stoßen ständig zusammen und kollidieren miteinander.
Wasserstoffbrücken werden immer gebildet und gebrochen, wenn sich Wassermoleküle aneinander vorbei bewegen.,
Bei Raumtemperatur ist der flüssige Zustand durch eine relativ hohe mittlere kinetische Energie für die Wassermoleküle gekennzeichnet.
Um diese Moleküle so zu verlangsamen, dass die Wasserstoffbrücken, die zwischen einzelnen Wassermolekülen gebildet werden, nicht mehr gebrochen werden, müssen Sie Energie aus dem System nehmen.
Wenn sich Wasser in seinem festen Zustand befindet, bleiben die Moleküle in einem Kristallnetzwerk „stecken“. Die durchschnittliche kinetische Energie der Moleküle kann die Wasserstoffbrücken nicht mehr überwältigen, und so entsteht Eis.,
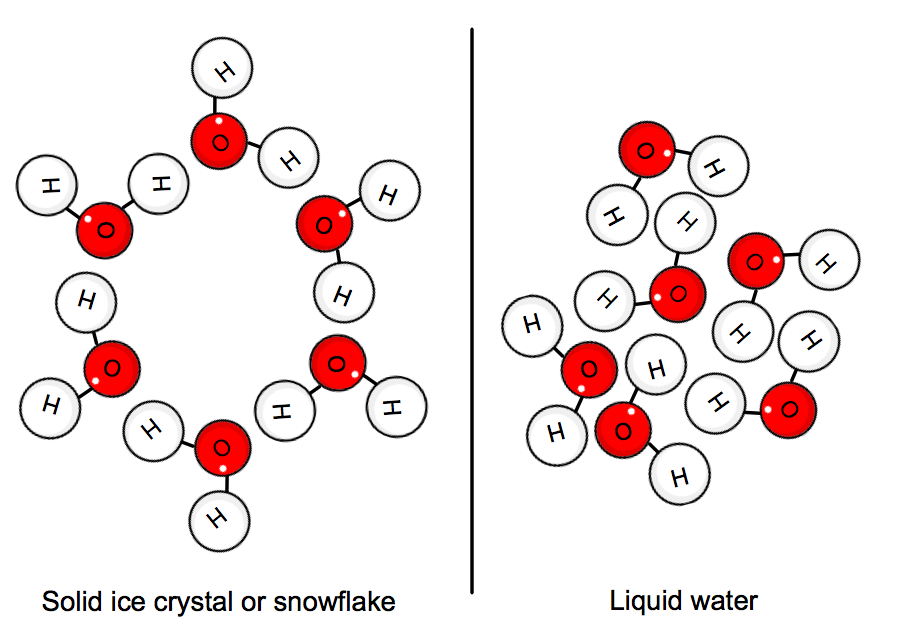
Dies impliziert, dass Wärme vom System, d.h. dem Wasser, abgegeben werden muss, um alles genug zu verlangsamen, damit sich der Kristall bilden kann.
Als Ergebnis ist das Fressen von Wasser ein exothermer Prozess, da Wärme aus dem System entfernt wird.
Ein endothermer Prozess würde bedeuten, dass dem System Wärme zugeführt werden muss. Dies ist hier eindeutig nicht der Fall, da die Bereitstellung von Wärme die durchschnittliche kinetische Energie der Wassermoleküle tatsächlich erhöhen würde.,
Das Schmelzen von Eis ist ein endothermer Prozess, da Sie Wärme bereitstellen müssen, damit die Moleküle die Wasserstoffbrücken überwältigen und sich wieder bewegen können.
