I linfociti T svolgono un ruolo centrale nella protezione degli esseri umani contro patogeni intracellulari o antigeni tumorali che richiedono risposte immunitarie mediate dalle cellule T. Le cellule T, in particolare le cellule T CD8+, possono essere attivate per uccidere le cellule tumorali o le cellule infette dopo aver riconosciuto gli antigeni. Le cellule T CD8 + sono composte da 3 sottoinsiemi principali tra cui cellule T naïve, effettore e memoria. Le cellule T naïve sono le cellule T primarie che non hanno mai incontrato l’agente patogeno prima., Le cellule T effettrici sono sviluppate da cellule T naïve quando esposte agli antigeni. La maggior parte delle cellule effettrici saranno rimosse attraverso l’apoptosi dopo l’eliminazione del patogeno per mantenere l’equilibrio immunitario.
Tuttavia, una piccola porzione di cellule T a vita lunga rimane ancora per una risposta rapida alla riesposizione del patogeno. Questo tipo di cellule è chiamato cellule T di memoria. Poiché le cellule T di memoria sono state addestrate a riconoscere antigeni specifici, attiveranno una risposta immunitaria più veloce e più forte dopo aver incontrato lo stesso antigene. Ecco come funzionano i vaccini per proteggerci dalle infezioni.,
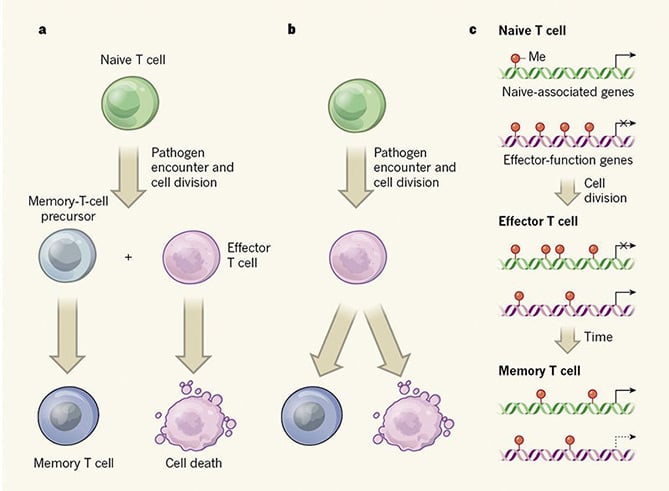
I vaccini sono stati usati per secoli. Tuttavia, non è ancora chiaro come vengono generate le celle T di memoria nonostante si tratti di un campo sottovalutato. Comprendere le origini delle cellule T della memoria sarà utile per la progettazione del vaccino. Sono stati proposti due modelli principali per spiegare il meccanismo alla base. Il modello A supporta l’ipotesi che le cellule T di memoria siano derivate da cellule T naïve; il modello B suggerisce che un sottoinsieme di cellule effettore dà origine a cellule T di memoria.
Infine, questo dibattito di lunga durata ha ora una risposta., Due gruppi di ricerca, in comune con un leader Dr. Rafi Ahmed alla Emory University School of Medicine, hanno pubblicato due articoli online su Nature questa settimana con le forti evidenze che concordano con il modello B.
Entrambi i due documenti si concentrano sul percorso di elaborazione delle cellule T CD8+. Akondy et al. utilizzato deuterio etichettato cellule T umane dopo la vaccinazione contro il virus della febbre gialla per monitorare le cellule T CD8+, mentre Youngblood et al. modello di topo impiegato per studiare la formazione di cellule T di memoria ., Hanno controllato le modificazioni epigenetiche delle cellule T naïve, effettore e memoria, nonché la configurazione del DNA in questi tre tipi di cellule T.
La metilazione del DNA, un tipo di alterazione epigenetica associata alla repressione genica, è stata analizzata da Youngblood e dai suoi colleghi. Hanno scoperto che la metilazione del DNA determina la funzione e lo stato tra tre tipi di cellule T., Sia le cellule T effettrici che le cellule T di memoria hanno profili di metilazione del DNA simili per i geni a funzione effettrice con meno aggiunta di gruppo metilico rispetto alle cellule T naïve, il che favorisce una rapida risposta alla riesposizione del patogeno per le cellule T di memoria. Questa forte evidenza è coerente con il modello B. Inoltre, le cellule T di memoria hanno bisogno di meno metilazione dei geni associati naïve per mantenere una lunga fase di vita dopo l’insorgenza delle cellule T effettrici. Gli autori hanno inoltre identificato una DNA metiltransferasi chiamata Dnmt3a che regola gli stadi delle cellule T attraverso la metilazione del DNA.
Akondy et al., inoltre ha analizzato i modelli di accessibilità del DNA e ha scoperto che le cellule T di memoria presentano un modello di accessibilità della cromatina paragonabile a quello delle cellule T effettori. Ciò fornisce ulteriori prove a sostegno dell’idea che le cellule T di memoria siano sorte dalle cellule effettori.
Entrambi gli studi hanno chiaramente dimostrato che le cellule T della memoria sono generate dalle cellule T effettori attraverso modificazioni epigenetiche, e gli studi hanno anche rivelato che Dnmt3a funziona come una metiltransferasi chiave del DNA che influenza la formazione delle cellule T della memoria. Questa nuova scoperta getta luce su una migliore strategia di progettazione del vaccino., Inoltre, contribuisce al miglioramento delle immunoterapie mirate a Dnmt3a.
