T lymfocyten spelen een centrale rol bij de bescherming van de mens tegen intracellulaire pathogenen of tumorantigenen waarvoor t-celgemedieerde immuunreacties nodig zijn. De cellen van T, in het bijzonder CD8+ T-cellen, kunnen worden geactiveerd om kankercellen of besmette cellen te doden na het erkennen van antigenen. CD8 + T-cellen zijn samengesteld uit 3 belangrijke subsets waaronder naïeve, effector-en geheugenT-cellen. De naïeve cellen van T zijn de primaire cellen van T die geen ziekteverwekker eerder hebben ontmoet., Effector T cellen worden ontwikkeld uit naïeve T cellen wanneer blootgesteld aan antigenen. De meeste effectorcellen zullen worden verwijderd door middel van apoptosis na pathogeen eliminatie om het immuunsysteem evenwicht te behouden.
een klein deel van de langlevende T-cellen blijft echter nog steeds over voor een snelle respons bij herblootstelling van het pathogeen. Dit soort cellen worden geheugen-T-cellen genoemd. Omdat de cellen van geheugenT zijn opgeleid om specifieke antigenen te erkennen, zullen zij een snellere en sterkere immune reactie na het ontmoeten van het zelfde antigeen teweegbrengen. Zo beschermen vaccins ons tegen infecties.,
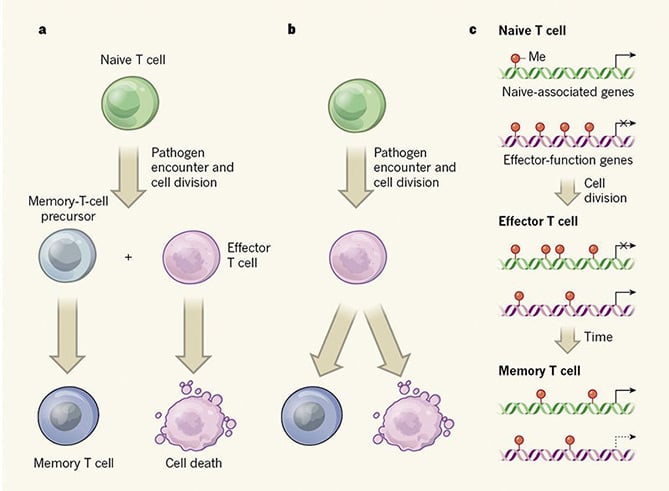
vaccins worden al eeuwen gebruikt. Nochtans, is het nog onduidelijk dat hoe de cellen van geheugenT ondanks het feit worden gegenereerd dat het een understudied gebied is. Het begrijpen van de oorsprong van geheugen T-cellen zal gunstig zijn voor het ontwerp van het vaccin. Er zijn twee belangrijke modellen voorgesteld om het mechanisme erachter te verklaren. Model A steunt de hypothese dat de cellen van geheugenT uit naïeve cellen van T worden afgeleid; Model B stelt voor dat een subset van effectorcellen tot cellen van geheugenT leidt.
ten slotte heeft dit langdurige debat nu een antwoord., Twee onderzoeksteams, samen met één leider Dr.Rafi Ahmed van de Emory University School Of Medicine, publiceerden deze week twee papers online in Nature met de sterke bewijzen die overeenkomen met model B.
beide papers richten zich op de verwerking van CD8+ T-cellen. Akondy et al. gebruikt deuterium geëtiketteerd menselijke T cellen na gele koorts virus Vaccinatie om CD8+ T cellen te volgen, terwijl Youngblood et al. gebruikt muismodel om de vorming van geheugenT cellen te onderzoeken ., Zij controleerden de epigenetische wijzigingen van naïeve, effector en geheugenT cellen, evenals de configuratie van DNA in die drie types van T cellen.
DNA methylering, een soort epigenetische verandering die geassocieerd wordt met genonderdrukking, werd geanalyseerd door Youngblood en zijn collega ‘ s. Zij vonden dat methylation van DNA functie en status onder drie types van cellen van T bepaalt., Zowel de cellen van effectort als de cellen van geheugenT hebben gelijkaardige methylatieprofielen van DNA voor effector-functiegenen met minder methylgroeptoevoeging in vergelijking met naïeve cellen van T, die snelle reactie op ziekteverwekkerherblootstelling voor cellen van geheugenT begunstigt. Dit sterke bewijs is consistent met model B. Bovendien hebben geheugenT-cellen minder methylering van naïeve-geassocieerde genen nodig om een lang levend stadium te behouden na het ontstaan van effectort-cellen. De auteurs identificeerden verder een methyltransferase van DNA genoemd Dnmt3a die de cellenstadia van T door methylation van DNA regelt.
Akondy et al., analyseerde ook de patronen van de toegankelijkheid van DNA en vond dat de cellen van geheugenT een chromatin toegankelijkheidspatroon voorstellen vergelijkbaar met dat van effectort cellen. Dit verstrekt verder bewijsmateriaal ondersteunend het idee dat de cellen van geheugenT uit effectorcellen zijn ontstaan.
beide studies toonden duidelijk aan dat geheugen-T-cellen worden gegenereerd uit effector-T-cellen door epigenetische modificaties, en de studies toonden ook aan dat Dnmt3a werkt als een belangrijke DNA-methyltransferase die de vorming van geheugen-T-cellen beïnvloedt. Deze nieuwe bevinding werpt licht op een betere strategie voor het ontwerpen van vaccins., Bovendien draagt het bij tot de verbetering van immunotherapieën gericht op Dnmt3a.
