Før du svarer på spørsmålet, er det svært viktig å forstå hva som skjer fra energetical synspunkt når vannet går fra flytende til fast.
La oss si at du starter ved romtemperatur. Når vannet molekylene i flytende fase, de er i konstant bevegelse rundt, hele tiden bumping og collisind med hverandre.
Hydrogen obligasjoner er alltid blir dannet og ødelagt som vann molekylene bevege seg forbi hverandre.,
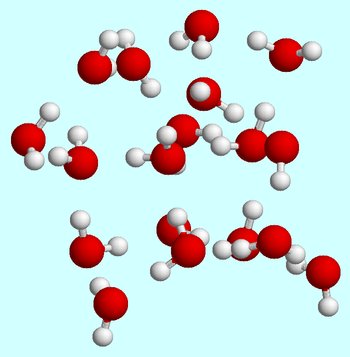
Ved romtemperatur, flytende tilstand er preget av en relativt høy gjennomsnittlig kinetisk energi for vannmolekylene.
Nå, for å bremse disse molekylene ned nok til at hydrogen obligasjoner som er dannet mellom individuelle vannmolekylene ikke lenger er ødelagt, må du ta energi ut av systemet.
Når vannet er i sin solid state-molekylene er «stuck» i posisjon i en krystall nettverk. Den gjennomsnittlige kinetiske energien til molekylene kan ikke lenger å overmanne hydrogen obligasjoner, og så isen er dannet.,
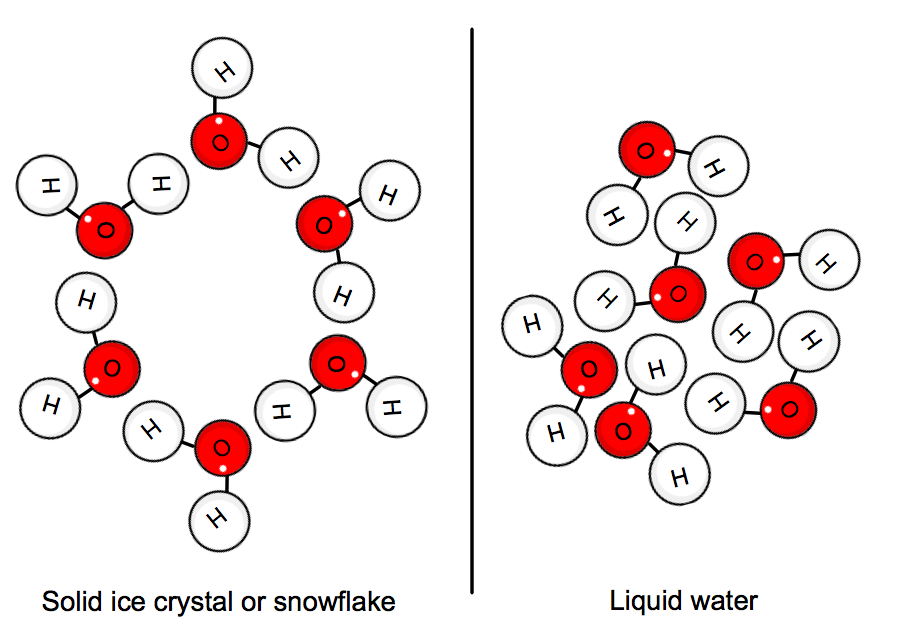
Dette innebærer at varmen skal være gitt ut av systemet, dvs. vann, for å roe alt ned nok for crystal å danne.
Som aresult, den frezing av vann er en eksoterme prosessen, fordi varmen blir fjernet fra systemet.
En endothermic prosessen ville innebære at varmen skal leveres til systemet. Det er helt klart ikke tilfelle her, siden det gir varme faktisk ville øke den gjennomsnittlige kinetiske energien til vannmolekylene.,
issmeltingen er et endothermic prosess fordi du trenger for å gi varme for å tillate molekyler for å overmanne hydrogen obligasjoner og begynne å bevege seg om igjen.
