innan du svarar på frågan är det mycket viktigt att förstå vad som exakt händer ur energisk synvinkel när vatten går från vätska till fast.
låt oss säga att du börjar vid rumstemperatur. När vattenmolekyler befinner sig i vätskefasen rör de sig ständigt, ständigt stöter och kollisind med varandra.
vätebindningar bildas alltid och bryts när vattenmolekyler rör sig förbi varandra.,
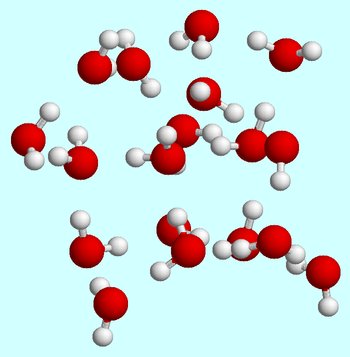
vid rumstemperatur kännetecknas vätsketillståndet av en relativt hög genomsnittlig kinetisk energi för vattenmolekylerna.
nu, för att sakta ner dessa molekyler tillräckligt så att vätebindningarna som bildas mellan enskilda vattenmolekyler inte längre bryts, måste du ta energi ur systemet.
När vatten är i fast tillstånd ”fastnar” molekylerna i ett kristallnät. Molekylernas genomsnittliga kinetiska energi kan inte längre övermanna vätebindningarna, och så bildas is.,
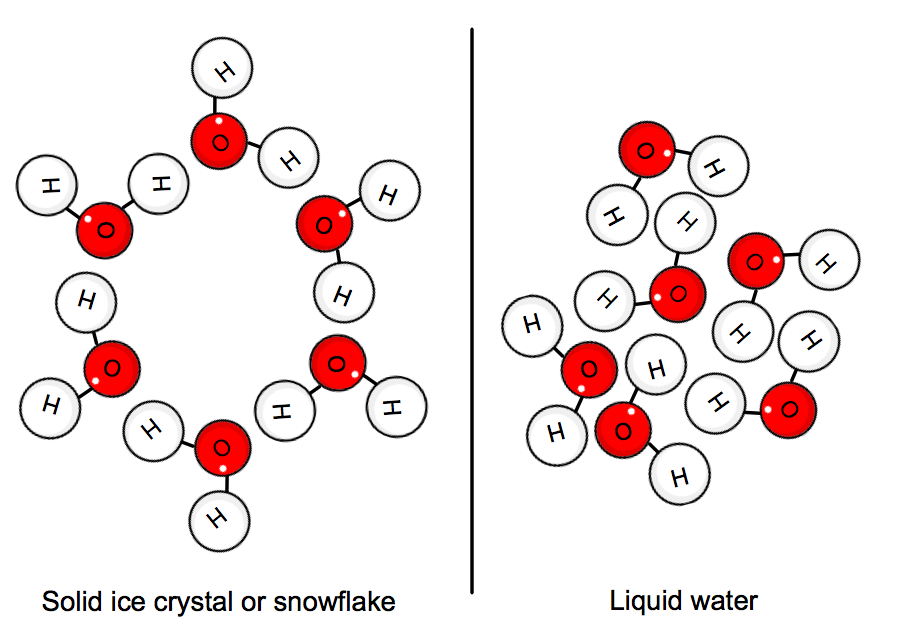
detta innebär att värme måste ges av systemet, dvs. vattnet, för att sakta ner allt tillräckligt för att kristallen ska bildas.
som ett resultat är frezing av vatten en exoterm process eftersom värme tas bort från systemet.
en endotermisk process skulle innebära att värme måste levereras till systemet. Det är uppenbarligen inte fallet här, eftersom att tillhandahålla värme faktiskt skulle öka den genomsnittliga kinetiska energin hos vattenmolekylerna.,
smältande is är en endotermisk process eftersom du måste ge värme för att molekylerna ska kunna övermanna vätebindningarna och börja röra sig igen.
