før du besvarer spørgsmålet, er det meget vigtigt at forstå, hvad der nøjagtigt sker fra energetisk synspunkt, når vand går fra væske til fast stof.
lad os sige, at du starter ved stuetemperatur. Når vandmolekyler er i væskefasen, bevæger de sig konstant rundt, støder konstant og kolliderer med hinanden.
hydrogenbindinger dannes altid og brydes, når vandmolekyler bevæger sig forbi hinanden.,
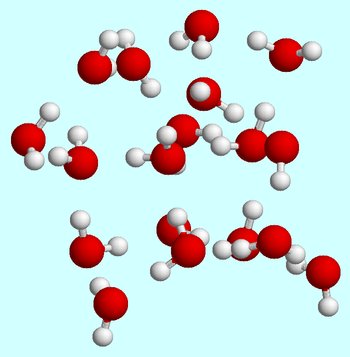
ved stuetemperatur er væsketilstanden kendetegnet ved en relativt høj gennemsnitlig kinetisk energi for vandmolekylerne.
nu, for at bremse disse molekyler ned nok, så de hydrogenbindinger, der dannes mellem individuelle vandmolekyler, ikke længere brydes, skal du tage energi ud af systemet.
når vand er i sin faste tilstand, “sidder molekylerne” i position i et krystalnetværk. Molekylernes gennemsnitlige kinetiske energi kan ikke længere overmande hydrogenbindingerne, og så dannes is.,
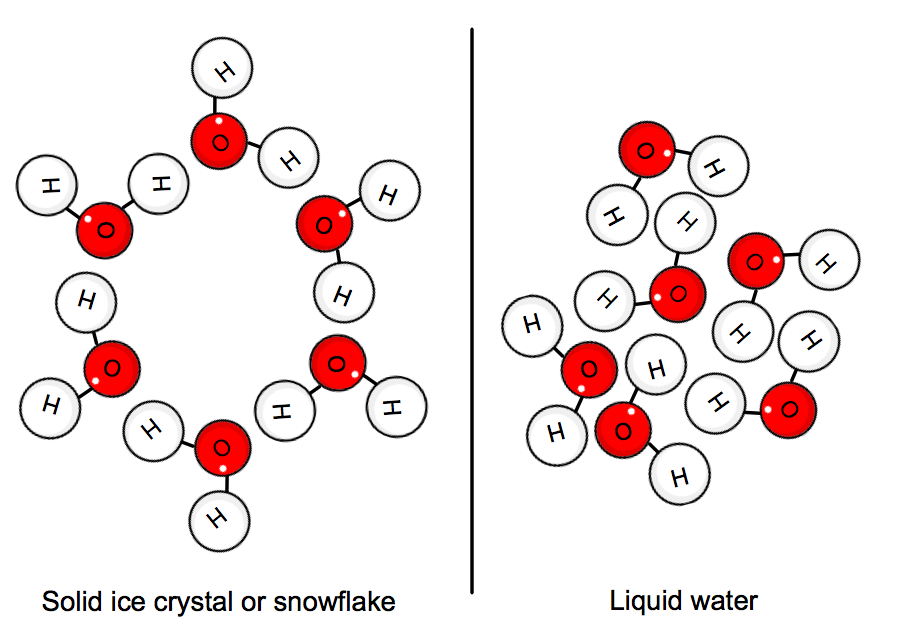
Dette indebærer, at varme skal afgives af systemet, dvs.vandet, for at bremse alt nok til, at krystallen dannes.
som erResultatet er frezinging af vand en eksoterm proces, fordi varme fjernes fra systemet.
en endoterm proces ville betyde, at varme skal leveres til systemet. Det er helt klart ikke tilfældet her, da levering af varme faktisk ville øge den gennemsnitlige kinetiske energi i vandmolekylerne.,
smeltende is er en endoterm proces, fordi du er nødt til at give varme for at give molekylerne mulighed for at overmande hydrogenbindingerne og begynde at bevæge sig igen.
