Los linfocitos T desempeñan un papel central en la protección de los seres humanos contra patógenos intracelulares o antígenos tumorales que requieren respuestas inmunitarias mediadas por células T. Las células T, en particular las células T CD8+, se pueden activar para destruir células cancerosas o células infectadas después de reconocer antígenos. Las células T CD8+ se componen de 3 subconjuntos principales que incluyen células T naïve, efectoras y de memoria. Las células T Naïve son las células T primarias que no han encontrado patógenos antes., Las células T efectoras se desarrollan a partir de células T naïve cuando se exponen a antígenos. La mayoría de las células efectoras se eliminarán a través de la apoptosis después de la eliminación del patógeno para mantener el equilibrio inmunológico.
sin embargo, una pequeña porción de células T de larga vida aún permanece para una respuesta rápida tras la reexposición del patógeno. Este tipo de células se llama células T de memoria. Debido a que las células T de memoria han sido entrenadas para reconocer antígenos específicos, desencadenarán una respuesta inmune más rápida y más fuerte después de encontrar el mismo antígeno. Así es como funcionan las vacunas para protegernos contra la infección.,
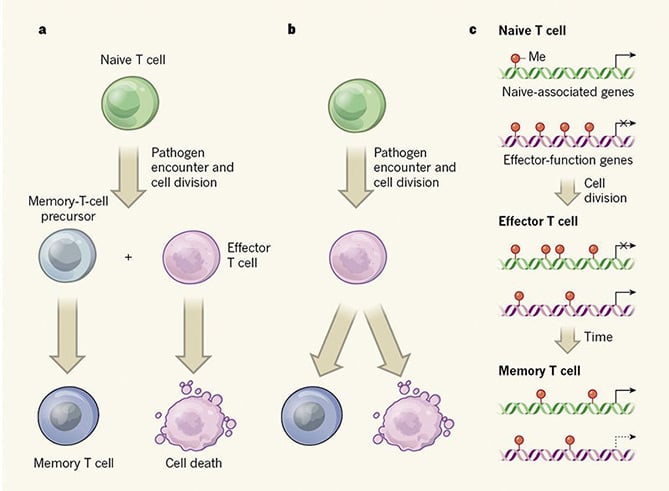
las Vacunas se han utilizado durante siglos. Sin embargo, todavía no está claro cómo se generan las células T de memoria a pesar del hecho de que es un campo poco estudiado. Comprender los orígenes de las células T de memoria será beneficioso para el diseño de vacunas. Se han propuesto dos modelos principales para explicar el mecanismo subyacente. El modelo a apoya la hipótesis de que las células T de memoria se derivan de células T naïve; el modelo B sugiere que un subconjunto de células efectoras da lugar a células T de memoria.
finalmente, este debate de larga duración tiene una respuesta ahora., Dos equipos de investigación, en común con un líder, el Dr. Rafi Ahmed de la Facultad de Medicina de la Universidad de Emory, publicaron dos artículos en línea en Nature esta semana con fuertes evidencias de acuerdo con el modelo B.
ambos artículos se centran en la vía de procesamiento de las células T CD8+. Akondy et al. utilizó células T humanas etiquetadas con deuterio después de la vacunación con el virus de la fiebre amarilla para rastrear las células T CD8+, mientras que Youngblood et al. modelo de ratón empleado para investigar la formación de células T de memoria ., Verificaron las modificaciones epigenéticas de las células T naïve, efectoras y de memoria, así como la configuración del ADN en esos tres tipos de células T.
la metilación del ADN, un tipo de alteración epigenética que se asocia con la represión génica, fue analizada por Youngblood y sus colegas. Encontraron que la metilación del ADN determina la función y el estado entre tres tipos de células T., Tanto las células T efectoras como las células T de memoria tienen perfiles de metilación de ADN similares para los genes de función efectora con menos adición de grupo metilo en comparación con las células T naïve, lo que favorece una respuesta rápida a la reexposición de patógenos para las células T de memoria. Esta fuerte evidencia es consistente con el modelo B. Además, las células T de memoria necesitan menos metilación de genes asociados a naïve para mantener una etapa de vida prolongada después de surgir de las células T efectoras. Los autores identificaron además una metiltransferasa de ADN llamada Dnmt3a que regula las etapas de las células T A través de la metilación del ADN.
Akondy et al., también se analizaron los patrones de accesibilidad al ADN y se encontró que las células T de memoria presentan un patrón de accesibilidad a la cromatina comparable al de las células T efectoras. Esto proporciona evidencia adicional que apoya la idea de que las células T de memoria surgen de las células efectoras.
ambos estudios demostraron claramente que las células T de memoria se generan a partir de células T efectoras a través de modificaciones epigenéticas, y los estudios también revelaron que Dnmt3a funciona como una metiltransferasa de ADN clave que afecta la formación de células T de memoria. Este nuevo hallazgo arroja luz sobre una mejor estrategia de diseño de vacunas., Además, contribuye a la mejora de las inmunoterapias dirigidas a Dnmt3a.
