síntesis de aspirina
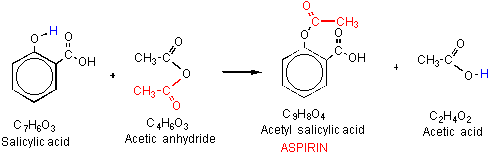
aspirina o el ácido acetil salicílico (AAS) es un derivado del ácido salicílico, que se utiliza como un analgésico para diversas dolencias del cuerpo tales como dolor de cabeza. La aspirina muestra propiedades antiplaquetarias o anticoagulantes al inhibir las prostaglandinas, reparando así los vasos sanguíneos dañados., Por lo tanto, la aspirina se usa en dosis bajas a largo plazo en el tratamiento de ataques cardíacos, accidentes cerebrovasculares y en personas que tienen altos riesgos de formación de coágulos de sangre. La síntesis de anhídrido acetil salicílico a partir del ácido salicílico y el anhídrido acético es catalizada por el ácido fosfórico. La eficiencia se estima por el tiempo necesario para completar la reacción.
Esquema 3.,flask
Ice cubes
Hot plate
Microwave oven
Stirring rod
Buchner funnel
Safety goggles
Stop watch
Experimental Procedure
18 ml of acetic anhydride was slowly added to 10 grams of salicylic acid in a 250 ml Erlenmeyer flask in the hood., Se añadieron cuidadosamente 10 a 20 gotas de ácido fosfórico al 85% a la solución y se mezclaron a fondo. La mezcla se calentó en una placa caliente hasta que todo el ácido salicílico se disolvió. Una vez completada la reacción, se añadieron 20 gotas de agua destilada a la mezcla, seguidas de 20 ml de agua destilada. La solución se enfrió en un baño de hielo hasta que la aspirina cristalizó. En caso de no formación de cristales, las paredes del matraz se rayaron con una varilla de agitación para iniciar la cristalización. Los cristales se filtraron con un filtro Buchner y se extrajeron con agua fría., El sólido se secó en un horno a 100 °C durante unos 30 minutos, se pesó y se calculó el rendimiento. El experimento se repitió en un horno de microondas y se comparó el rendimiento. Otros análisis podrían incluir mediciones del punto de fusión, IR y RMN.

Figura 10. Representa el producto final obtenido tras la síntesis.
resultados y discusión
las estructuras sólidas de ácido salicílico se disolvieron en presencia de anhídrido acético que es catalizado por ácido., La mezcla disuelta en el enfriamiento produjo cristales blancos de aspirina. La energía correspondiente consumida por cada método de calentamiento se tabula a continuación.
Cuadro 5. La energía consumida para la reacción de síntesis.
a partir de los datos presentados en la tabla 5, el método de síntesis por microondas demostró ser más eficiente que la placa caliente. Higo. 10 muestra el producto final de aspirina obtenido después del proceso de síntesis. El proceso de síntesis se mejoró en el caso del método de calentamiento por microondas, ahorrando así energía., El proceso de microondas también produjo una cantidad ligeramente mayor de producto que la placa caliente.
El porcentaje de energía ahorrada por el horno de microondas sobre el horno convencional, como fue registrado por el medidor de potencia,
![]()
