Synthese von Aspirin
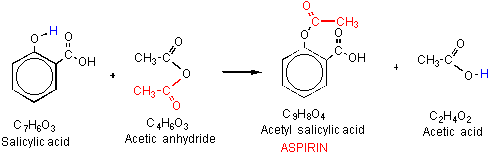
Aspirin oder Acetylsalicylsäure (ASA) ist ein Derivat von Salicylsäure, das als schmerzmittel für verschiedene Körperbeschwerden wie Kopfschmerzen. Aspirin zeigt blutplättchen-oder gerinnungshemmende Eigenschaften, indem es die Prostaglandine hemmt und dadurch beschädigte Blutgefäße repariert., Daher wird Aspirin in niedrigen Dosen auf Langzeitbasis bei der Behandlung von Herzinfarkten, Schlaganfällen und bei Menschen mit hohem Risiko für die Bildung von Blutgerinnseln verwendet. Die Synthese von Acetylsalicylsäureanhydrid aus Salicylsäure und Essigsäureanhydrid wird durch Phosphorsäure katalysiert. Die Effizienz wird durch die Zeit geschätzt, die benötigt wird, um die Reaktion abzuschließen.
Schema 3.,flask
Ice cubes
Hot plate
Microwave oven
Stirring rod
Buchner funnel
Safety goggles
Stop watch
Experimental Procedure
18 ml of acetic anhydride was slowly added to 10 grams of salicylic acid in a 250 ml Erlenmeyer flask in the hood., 10 bis 20 Tropfen 85 % Phosphorsäure wurden vorsichtig in die Lösung gegeben und gründlich gemischt. Die Mischung wurde auf einer heißen Platte erhitzt, bis die gesamte Salicylsäure gelöst war. Sobald die Reaktion abgeschlossen war, wurden vorsichtig 20 Tropfen destilliertes Wasser zu der Mischung gegeben, gefolgt von 20 ml destilliertem Wasser. Die Lösung wurde auf einem Eisbad abgekühlt, bis Aspirin kristallisierte. Im Falle einer Kristallbildung wurden die Wände des Kolbens mit einem Rührstab zerkratzt, um die Kristallisation zu initiieren. Die Kristalle wurden mit einem Buchner-Filter filtriert und mit gekühltem Wasser extrahiert., Der Feststoff wurde dann etwa 30 Minuten in einem Ofen bei 100 °C getrocknet, gewogen und die Ausbeute berechnet. Das experiment wurde wiederholt, in einem Mikrowellenherd und der Ertrag war im Vergleich. Weitere Analysen könnten Schmelzpunkt -, IR-und NMR-Messungen umfassen.

Abbildung 10. Stellt das nach der Synthese erhaltene Endprodukt dar.
Ergebnisse und Diskussion
Feste Salicylsäurestrukturen wurden in Gegenwart von Essigsäureanhydrid gelöst, das durch Säure katalysiert wird., Die gelöste Mischung beim Abkühlen produzierte weiße Kristalle von Aspirin. Die entsprechende Energie, die bei jeder Heizmethode verbraucht wird, ist unten tabelliert.
Tabelle 5. Die Energie, die für die Synthesereaktion verbraucht wird.
Aus den in Tabelle 5 dargestellten Daten erwies sich die Mikrowellen-Synthesemethode als effizienter als die Kochplatte. Abb. 10 zeigt das endgültige Aspirin-Produkt, das nach dem Syntheseprozess erhalten wurde. Der Syntheseprozess wurde im Falle der Mikrowellenmethode des Erhitzens verbessert, wodurch Energie gespart wurde., Der Mikrowellenprozess ergab auch eine etwas höhere Produktmenge als die Heizplatte.
Der Prozentsatz der vom Mikrowellenofen über dem herkömmlichen Ofen eingesparten Energie, wie vom Leistungsmesser aufgezeichnet,
![]()
