Antes de responder à pergunta, é muito importante entender exatamente o que acontece do ponto de vista energético quando a água vai de líquido para sólido. digamos que começa à temperatura ambiente. Quando as moléculas de água estão na fase líquida, elas estão constantemente se movendo, constantemente batendo e colisindo umas com as outras. as ligações de hidrogénio estão sempre a ser formadas e quebradas à medida que as moléculas de água passam umas pelas outras.,
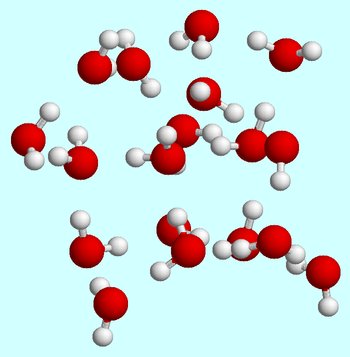
à temperatura ambiente, o estado líquido é caracterizado por uma energia cinética média relativamente elevada para as moléculas de água.
Agora, a fim de desacelerar estas moléculas o suficiente para que as ligações de hidrogênio que são formadas entre moléculas individuais de água não são mais quebradas, você precisa tirar energia do sistema.
Quando a água está em seu estado sólido, as moléculas estão “presas” em posição em uma rede de cristal. A energia cinética média das moléculas não pode mais dominar as ligações de hidrogênio, e assim o gelo é formado.,
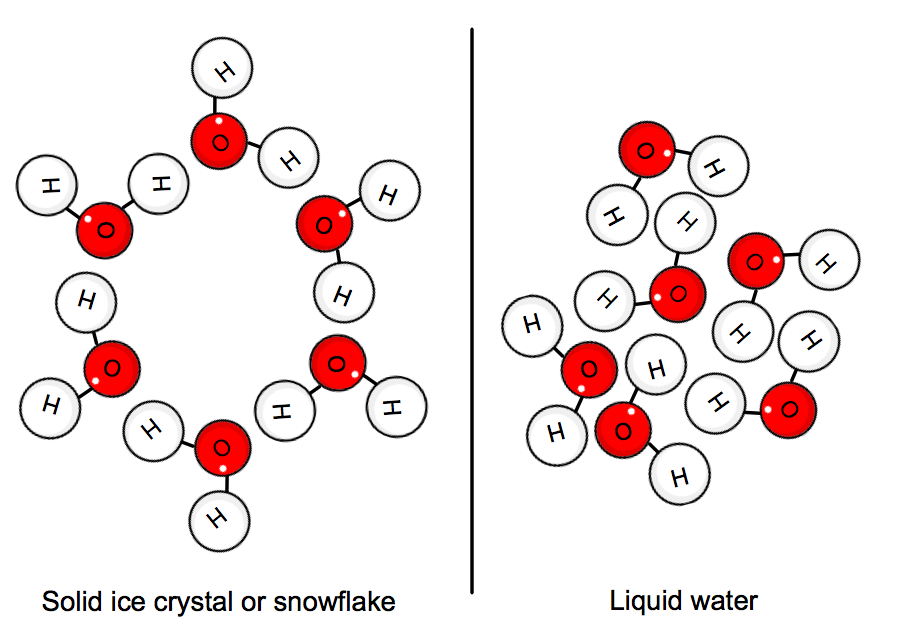
isto implica que o calor deve ser dado pelo sistema, ou seja, a água, a fim de abrandar tudo o suficiente para que o cristal se forme. como resultado, a frezing da água é um processo exotérmico porque o calor está sendo removido do sistema. um processo endotérmico implicaria que o calor deve ser fornecido ao sistema. Isso claramente não é o caso aqui, uma vez que fornecer calor realmente aumentaria a energia cinética média das moléculas de água.,
derreter gelo é um processo endotérmico porque você precisa fornecer calor, a fim de permitir que as moléculas para dominar as ligações de hidrogênio e começar a se mover novamente.
