cela vous est-il déjà arrivé? Vous courez en classe de gym et vous vous tordez la cheville. Ça fait mal et commence à gonfler. Votre professeur attrape la trousse de premiers soins et sort un paquet froid instantané. Après une bonne pression, le paquet devient vraiment froid, presque instantanément. Ce qui se passe? Comment les produits chimiques rendent-ils le paquet froid si rapidement? La réponse peut être trouvée en thermodynamique! C’est une branche de la science qui explore le transfert d’énergie., En thermodynamique, les réactions chimiques peuvent être classées comme endothermiques ou exothermiques.
Quels sont les deux principaux types de réactions thermodynamiques?
les réactions Exothermiques sont des réactions qui libèrent de l’énergie sous forme de chaleur. Vous connaissez probablement de nombreux exemples de ces réactions. Par exemple, brûler de l’essence dans le moteur d’une voiture est une réaction exothermique. Ce type particulier de réaction exothermique est connu sous le nom de réaction de combustion., Une réaction de combustion se produit lorsqu’un composé, tel que les hydrocarbures qui composent le carburant, réagit avec l’oxygène pour former un nouveau produit et produire de la chaleur.
Les réactions endothermiques sont le contraire des réactions exothermiques. Ils absorbent l’énergie thermique de leur environnement. Cela signifie que l’environnement des réactions endothermiques est plus froid à la suite de la réaction. La fonte de la glace est un exemple de ce type de réaction.
Comment savez-vous quel type de réaction thermodynamique se produit?
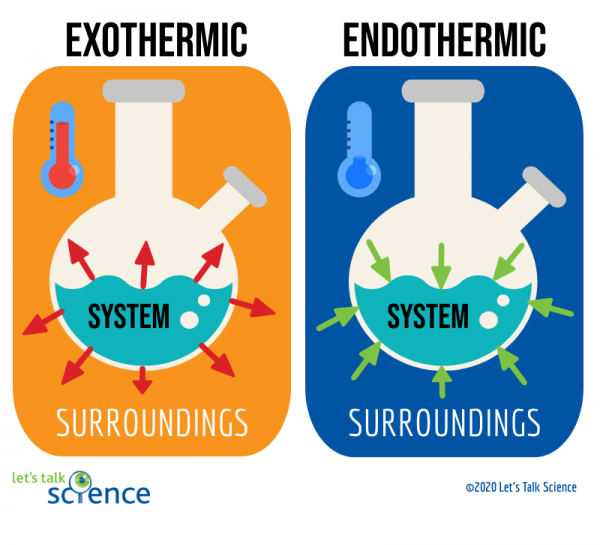
Une façon de le faire est de regarder le système et l’environnement d’une réaction., Le système est l’endroit où la réaction a lieu, et les environs sont la zone autour du système.
Pour déterminer si une réaction est exothermique ou endothermique, vous pouvez:
- mesure de la variation de température du système ou de son environnement, ou
- calculer l’énergie du système.
de ces deux méthodes, la mesure du changement de température est plus facile. Pour ce faire, il vous suffit de mesurer la température d’une réaction avant et après sa fin., Comme il peut parfois être difficile de mesurer la température dans le système d’une réaction, les scientifiques mesurent souvent la température de l’environnement à la place.
Il est possible de prévoir si une réaction endothermique ou exothermique en faisant un peu de mathématiques. Pour cela, il est utile d’en savoir un peu plus sur les réactions chimiques et les liaisons chimiques.,
Il y a deux côtés à toute réaction chimique. D’un côté sont les réactifs. Un réactif est la substance (ou les substances) avec laquelle vous commencez. De l’autre côté sont les produits. Un produit est la substance, ou les substances, que vous vous retrouvez avec après la réaction se produit.
Dans une réaction chimique, les liaisons chimiques dans les molécules de réactif sont cassés. De nouvelles liaisons se forment dans les molécules du produit. Un exemple serait la réaction de combustion entre le méthane (CH4) l’oxygène (O2) (les réactifs) qui produit du dioxyde de carbone (CO2) et des molécules d’eau (H20) (les produits)., Les liaisons sont rompues dans les molécules de méthane et d’oxygène. Les liaisons sont formées dans le dioxyde de carbone et les molécules d’eau.
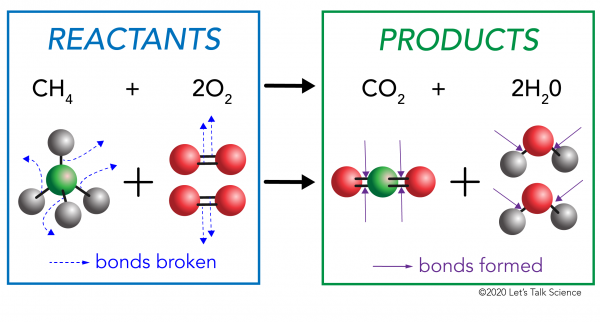
ce qu’il est important de savoir, c’est que l’énergie est nécessaire à la fois pour créer et pour rompre les liens., Pour déterminer si une réaction est exothermique ou endothermique, vous devez comparer la quantité d’énergie nécessaire pour rompre les liaisons des réactifs à la quantité d’énergie libérée lors de nouvelles obligations sont faites. Si la quantité d’énergie libérée lorsque les nouvelles liaisons sont formées dans les produits est plus grande, alors il s’agit d’une réaction exothermique. Si la quantité d’énergie nécessaire pour rompre les liaisons des réactifs est plus forte, il est une réaction endothermique.
Une façon de montrer cela est d’utiliser un diagramme d’énergie. L’énergie diagrammes montrent les niveaux d’énergie des réactifs et des produits dans une réaction.,
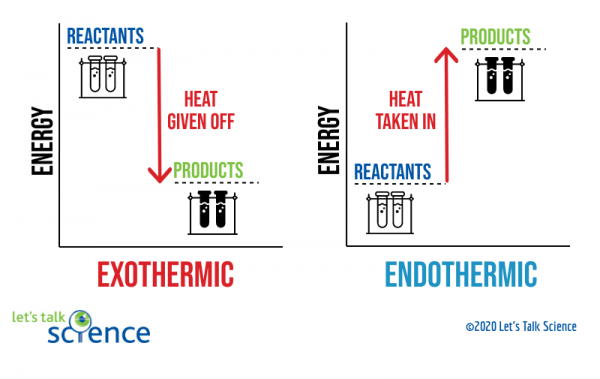
Vous pouvez le voir sur le schéma ci-dessus que le niveau d’énergie des produits d’une réaction exothermique est inférieure au niveau d’énergie des réactifs. La différence entre les niveaux d’énergie des réactifs et des produits est appelée changement d’enthalpie (ΔH). Dans une réaction exothermique, le ΔH est négatif. Dans une réaction endothermique, le ΔH est positif.,
le Saviez-vous?
Les scientifiques peuvent mesurer l’énergie dans les aliments en mesurant la quantité de chaleur dégagée par les aliments lorsqu’ils sont brûlés. Mesurée à l’aide d’un outil appelé une bombe calorimètre.
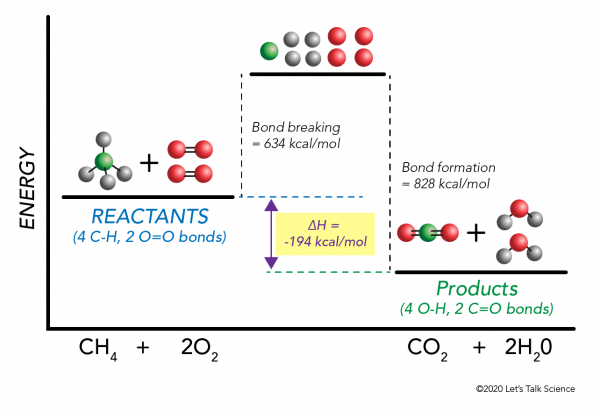
Il est possible de calculer ΔH sans même faire une expérience! Les scientifiques ont déterminé expérimentalement les énergies nécessaires pour créer et rompre des liaisons moléculaires spécifiques. Ces énergies sont connues sous le nom d’énergies de liaison moyennes.,r>
à l’Aide de la combustion du méthane exemple encore, les mathématiques fonctionne comme ceci:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
Depuis la variation d’enthalpie est négatif, nous savons que la réaction exothermique.,
comment la thermodynamique fonctionne-t-elle dans un pack froid?
maintenant, revenons à notre pack froid instantané. Un pack froid instantané est l’exemple parfait d’une réaction endothermique. Il existe de nombreux ingrédients possibles dans un pack froid instantané, mais ils contiennent souvent du nitrate d’ammonium solide et de l’eau.
le Saviez-vous?,
Le nitrate D’Ammonium est un sel de nitrate. Il est fortement utilisé dans l’agriculture comme engrais. Il est également utilisé comme explosif dans l’industrie minière.
Le nitrate d’ammonium est stocké dans un sac en plastique scellé entouré d’eau. Lorsque vous sautez le sac, le nitrate d’ammonium entre en contact avec l’eau et se dissout.
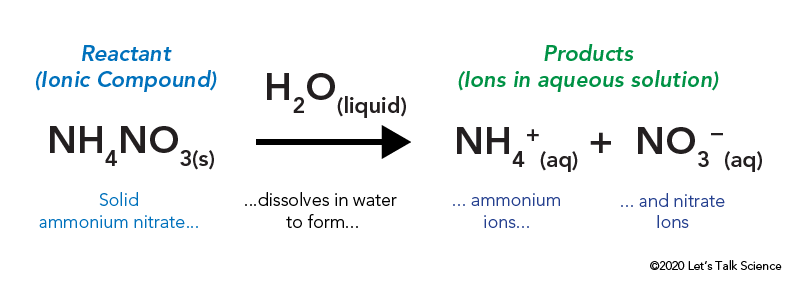
dissoudre un composé ionique, comme le sel de table ou le nitrate d’ammonium, implique de l’énergie. Comme d’autres types de réactions, l’énergie thermique peut être émise ou absorbée lorsque le matériau se dissout. Cette énergie est appelée l’énergie de la solution et peut être écrite comme ΔHsoln.
ΔHsoln = δ ΔH – ∑ΔH
plutôt que de calculer le ΔH pour les réactifs et les produits en utilisant les énergies de liaison, les scientifiques utilisent souvent des valeurs pré-calculées sur les tables D’enthalpie Standard de Formation (ΔH°f)., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
faisons le calcul pour calculer l’énergie de la solution
ΔHsoln = δ ΔH – δ ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 KJ
rappelez-vous au début que si ΔH est négatif, la réaction est exothermique et que si ΔH est positif, la réaction est endothermique? Eh bien, cela s’applique également à l’énergie des problèmes de solution. Puisque nous avons calculé que le ΔHsoln était positif (25,7 kJ), la réaction doit être endothermique. Nous savons que cela est vrai parce que le pack froid a rendu son environnement très froid!,
pour résumer…
Les réactions exothermiques et endothermiques sont importantes pour notre monde chimique. Ces réactions peuvent nous garder au chaud en dégageant de l’énergie (exothermique) ou nous refroidir en absorbant de l’énergie (endothermique).
