har detta någonsin hänt dig? Du kör i gymklass och du vrider din fotled. Det gör ont och börjar svälla upp. Din lärare tar tag i första hjälpen kit och drar ut en omedelbar kall pack. Efter en bra squeeze blir förpackningen riktigt kall, nästan omedelbart. Vad händer? Hur gör kemikalierna förpackningen kall så snabbt? Svaret finns i termodynamik! Detta är en gren av vetenskapen som utforskar överföringen av energi., I termodynamik kan kemiska reaktioner klassificeras som antingen endoterma eller exoterma.
vilka är de två huvudtyperna av termodynamiska reaktioner?
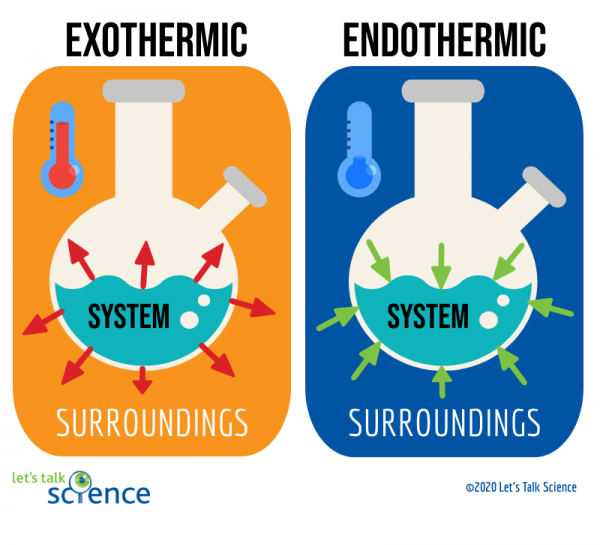
exoterma reaktioner är reaktioner som frigör energi i form av värme. Du är förmodligen bekant med många exempel på dessa reaktioner. Till exempel är brinnande bensin i en bils motor en exoterm reaktion. Denna speciella typ av exoterm reaktion är känd som en förbränningsreaktion., En förbränningsreaktion uppstår när en förening, såsom kolväten som utgör bränsle, reagerar med syre för att bilda en ny produkt och producera värme.
endoterma reaktioner är motsatsen till exoterma reaktioner. De absorberar värmeenergi från sin omgivning. Detta innebär att omgivningen av endoterma reaktioner är kallare som ett resultat av reaktionen. Smältande is är ett exempel på denna typ av reaktion.
Hur vet du vilken typ av termodynamisk reaktion som händer?
ett sätt att göra detta är genom att titta på systemet och omgivningen av en reaktion., Systemet är där reaktionen sker, och omgivningen är området runt systemet.
för att avgöra om en reaktion är exoterm eller endoterm kan du:
- mäta temperaturförändringen av systemet eller dess omgivning, eller
- beräkna systemets energi.
av dessa två metoder är det lättare att mäta temperaturförändringen. För att göra detta mäter du helt enkelt temperaturen på en reaktion före och efter det att den är klar., Eftersom det ibland kan vara svårt att mäta temperaturen i systemet med en reaktion, mäter forskare ofta omgivningens temperatur istället.
det är möjligt att förutsäga om en reaktion kommer att vara endotermisk eller exoterm genom att göra lite matte. För detta hjälper det att veta lite om kemiska reaktioner och kemiska bindningar.,
det finns två sidor till någon kemisk reaktion. På ena sidan är reaktanterna. Ett reaktant är det ämne (eller ämnen) som du börjar med. På andra sidan är produkterna. En produkt är ämnet, eller ämnen, som du slutar med efter att reaktionen händer.
i en kemisk reaktion bryts de kemiska bindningarna i reaktantmolekylerna. Nya bindningar bildas i produktmolekylerna. Ett exempel skulle vara förbränningsreaktionen mellan metan (CH4) syre (O2) (reaktanterna) som producerar koldioxid (CO2) och vatten (H20) molekyler (produkterna)., Bindningar bryts i metan och syremolekyler. Bindningar bildas i koldioxiden och vattenmolekylerna.
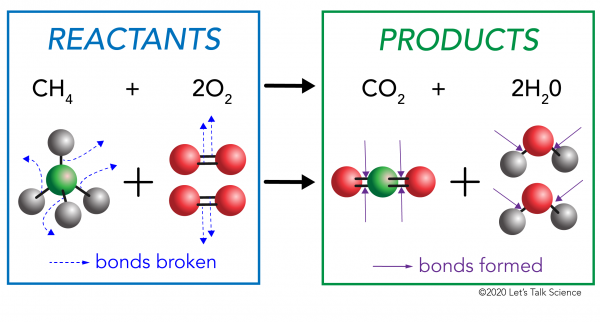
det som är viktigt att veta är att energi behövs för att både göra och bryta obligationer., För att avgöra om en reaktion är exoterm eller endoterm, måste du jämföra den mängd energi som behövs för att bryta reaktanternas bindningar till den mängd energi som frigörs när nya obligationer görs. Om mängden energi som frigörs när de nya bindningarna bildas i produkterna är större, är det en exoterm reaktion. Om mängden energi som behövs för att bryta reaktanternas bindningar är större, är det en endotermisk reaktion.
ett sätt att visa detta är att använda ett energischema. Energidiagram visar energinivåerna för reaktanter och produkter i en reaktion.,
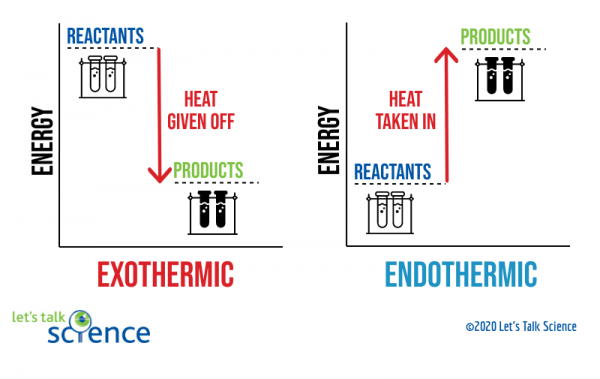
Du kan se från diagrammet ovan att energinivån för produkterna i en exoterm reaktion är lägre än reaktanternas energinivå. Skillnaden mellan reaktanternas och produkternas energinivåer kallas ENTALPIÄNDRINGEN (ΔH). I en exoterm reaktion är ΔH negativ. I en endotermisk reaktion är ΔH positiv.,
visste du?
forskare kan mäta energi i livsmedel genom att mäta hur mycket värme maten släpper ut när den bränns. De mäter detta med ett verktyg som kallas en bombkalorimeter.
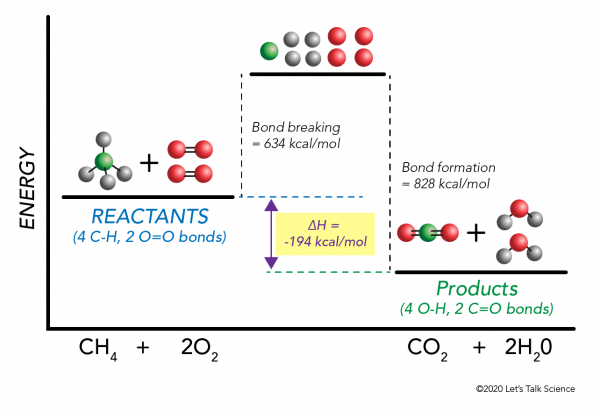
det är möjligt att beräkna ΔH utan att ens göra ett experiment! Forskare har bestämt experimentellt de energier som krävs för att göra och bryta specifika molekylära bindningar. Dessa energier är kända som genomsnittliga obligationsenergier.,r>
använda metanförbränningsexempel igen fungerar matematiken så här:
ΔH = –
= –
–
= –
= –
= 634 – 828
= – 194 kcal/mol
eftersom entalpiändringen är negativ vet vi att reaktionen blir exoterm.,
hur fungerar termodynamiken i ett kallt paket?
nu, låt oss gå tillbaka till vår instant cold pack. Ett omedelbart kallt paket är det perfekta exemplet på en endotermisk reaktion. Det finns många möjliga ingredienser i ett omedelbart kallt paket, men de innehåller ofta fast ammoniumnitrat och vatten.
visste du?,
ammoniumnitrat är ett nitratsalt. Det används starkt inom jordbruket som gödningsmedel. Det används också som explosivt i gruvindustrin.
ammoniumnitratet lagras i en förseglad plastpåse som omges av vatten. När du popar påsen kommer ammoniumnitratet i kontakt med vatten och löser upp.
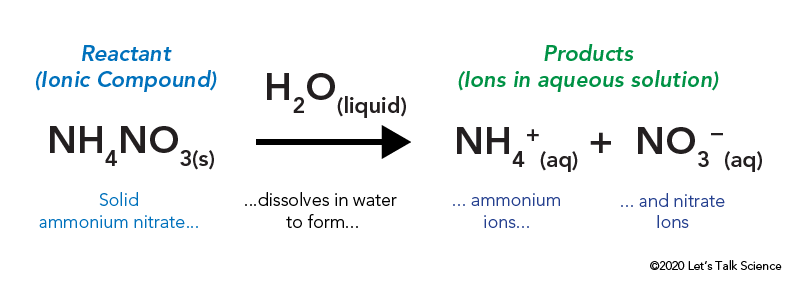
upplösning av en jonisk förening, som bordsalt eller ammoniumnitrat, innebär energi. Liksom andra typer av reaktioner kan värmeenergi ges bort eller tas in när materialet löses upp. Denna energi kallas lösningens energi och kan skrivas som ΔHsoln.
ΔHsoln = ΔH – IÖMN
I stället för att utarbeta ΔH för reaktanter och produkter som använder bondenergier använder forskare ofta förberäknade värden på Standard entalpi av Formationstabeller (ΔH°f)., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
låt oss göra matten för att beräkna lösningens energi
ΔHsoln = ΔH – ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 kJ
kom ihåg i början sa vi att om ΔH är negativ är reaktionen exoterm och att om ΔH är positiv är reaktionen endoterm? Tja, det gäller också energi av lösningsproblem. Eftersom vi beräknade att Δhsolen var positiv (25.7 kJ) måste reaktionen vara endotermisk. Vi vet att detta är sant eftersom det kalla paketet gjorde omgivningen väldigt kall!,
summerar…
exoterma och endoterma reaktioner är viktiga för vår kemiska Värld. Dessa reaktioner kan hjälpa till att hålla oss varma genom att ge bort energi (exoterm) eller hjälpa till att kyla ner oss genom att ta in energi (endoterm).
