előfordult már veled? Tornaórára jársz, és a bokádat is megcsavarodod. Fáj és elkezd duzzadni. A tanárod megragadja az elsősegély-készletet, és kihúz egy azonnali hideg csomagot. Egy jó préselés után a csomag nagyon hideg lesz, szinte azonnal. Mi történik? Hogyan teszik a vegyi anyagok ilyen gyorsan kihűlni a csomagot? A válasz megtalálható a termodinamikában! Ez a tudomány egy ága, amely feltárja az energia átadását., A termodinamikában a kémiai reakciók endoterm vagy exoterm kategóriába sorolhatók.
melyek a termodinamikai reakciók két fő típusa?
az exoterm reakciók olyan reakciók, amelyek hő formájában energiát bocsátanak ki. Valószínűleg ismeri ezeket a reakciókat. Például a benzin égése egy autó motorjában exoterm reakció. Ez a fajta exoterm reakció égési reakcióként ismert., Égési reakció akkor fordul elő, amikor egy vegyület, például az üzemanyagot alkotó szénhidrogének oxigénnel reagálnak egy új termék kialakítására és hőt termelnek.
az endoterm reakciók ellentétesek az exoterm reakciókkal. Elnyelik a hőenergiát a környezetükből. Ez azt jelenti, hogy az endoterm reakciók környezete a reakció következtében hidegebb. Az olvadó jég példa az ilyen típusú reakcióra.
honnan tudod, hogy milyen típusú termodinamikai reakció történik?
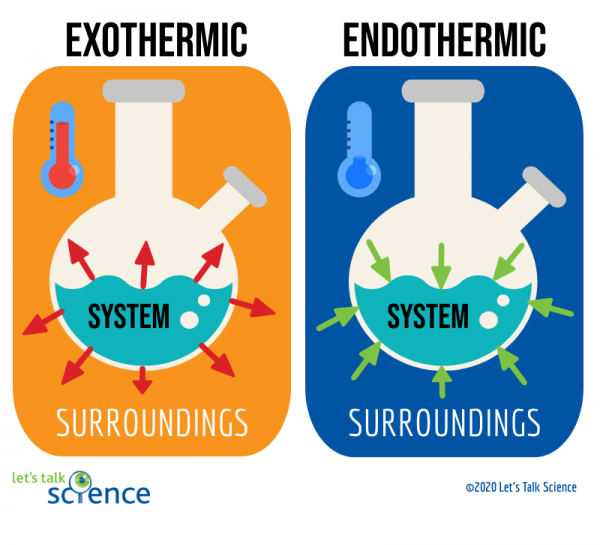
ennek egyik módja egy reakció rendszerének és környezetének vizsgálata., A rendszer az, ahol a reakció zajlik, a környezet pedig a rendszer körüli terület.
annak megállapításához, hogy egy reakció exoterm vagy endoterm, akkor:
- mérje meg a rendszer vagy annak környezetének hőmérsékletváltozását, vagy
- kiszámíthatja a rendszer energiáját. e két módszer közül
a hőmérsékletváltozás mérése könnyebb. Ehhez egyszerűen mérje meg a reakció hőmérsékletét a befejezés előtt vagy után., Mivel néha nehéz lehet mérni a hőmérsékletet a reakciórendszeren belül,a tudósok gyakran mérik a környezet hőmérsékletét.
lehetséges megjósolni, hogy egy reakció endoterm vagy exoterm lesz-e egy kis matematika elvégzésével. Ehhez segít egy kicsit megismerni a kémiai reakciókat és a kémiai kötéseket.,
bármely kémiai reakciónak két oldala van. Az egyik oldalon a reagensek. A reagens az az anyag (vagy anyagok), amellyel elkezdi. A másik oldalon vannak a termékek. A termék az az anyag, vagy anyagok, hogy a végén, miután a reakció történik.
egy kémiai reakcióban a reaktáns molekulák kémiai kötései megszakadnak. A termékmolekulákban új kötések alakulnak ki. Példa erre a metán (CH4) oxigén (O2) (a reaktánsok) közötti égési reakció, amely szén-dioxidot (CO2) és víz (H20) molekulákat (a termékeket) termel., A metán és az oxigénmolekulák kötései megszakadnak. A szén-dioxidban és a vízmolekulákban kötések képződnek.
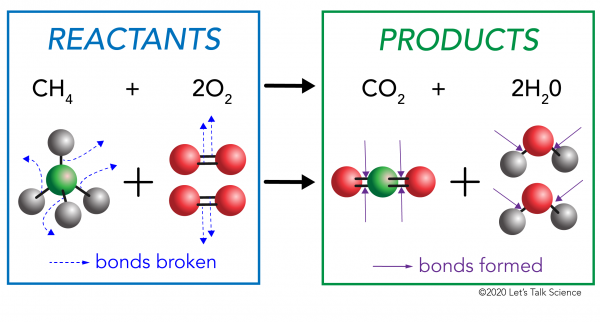
fontos tudni, hogy energiára van szükség mind a kötések létrehozásához, mind a megszakításához., Annak megállapításához, hogy egy reakció exoterm vagy endoterm, össze kell hasonlítania a reaktánsok kötéseinek megszakításához szükséges energia mennyiségét az új kötések során felszabaduló energia mennyiségével. Ha a termékekben az új kötések kialakulásakor felszabaduló energia mennyisége nagyobb, akkor exoterm reakció. Ha a reaktánsok kötéseinek megszakításához szükséges energia mennyisége nagyobb, akkor endoterm reakció.
az egyik módja annak, hogy megmutassuk ezt egy energia diagram használatával. Az energiagazdálkodási ábrák a reakcióban lévő reagensek és termékek energiaszintjét mutatják.,
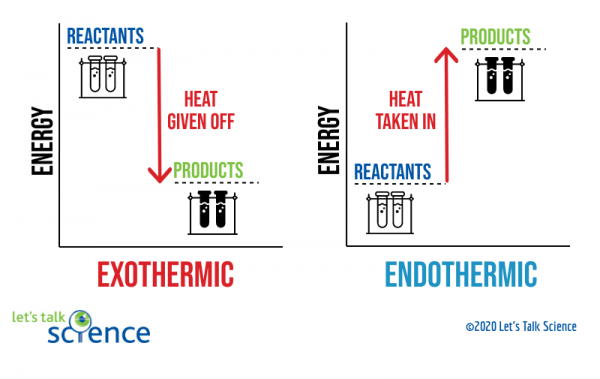
a fenti diagramból látható, hogy az exoterm reakció termékeinek energiaszintje alacsonyabb, mint a reaktánsok energiaszintje. A reaktánsok és a termékek energiaszintjei közötti különbséget entalpiás változásnak (ΔH) nevezzük. Exoterm reakcióban a ΔH negatív. Endoterm reakcióban a ΔH pozitív.,
tudta?
A tudósok mérhetik az élelmiszerek energiáját azáltal, hogy megmérik, hogy az élelmiszer mennyi hőt bocsát ki Égéskor. Ezt egy bomba kaloriméternek nevezett eszközzel mérik.
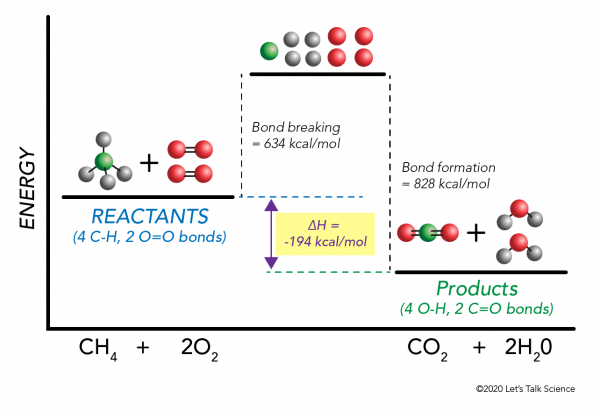
lehetőség van ΔH kiszámítására kísérlet nélkül is! A tudósok kísérletileg meghatározták a specifikus molekuláris kötések létrehozásához és megtöréséhez szükséges energiákat. Ezeket az energiákat átlagos kötési energiáknak nevezik.,r>
Használja a metán elégetése példa újra, hogy a matek nem úgy működik, mint ez:
ΔH = –
a= –
a= –
a= –
= 634 – 828
a= – 194 kcal/mol
Mivel az entalpia változás negatív, tudjuk, hogy a reakció exoterm.,
hogyan működnek a termodinamika hideg csomagolásban?
most térjünk vissza az azonnali hidegcsomagunkhoz. Az azonnali hidegcsomag tökéletes példa az endoterm reakcióra. Az azonnali hidegcsomagolásban sok lehetséges összetevő található, de gyakran tartalmaznak szilárd ammónium-nitrátot és vizet.
tudta?,
az ammónium-nitrát egy nitrátsó. Erősen használják a mezőgazdaságban műtrágyaként. Azt is használják, mint egy robbanásveszélyes a bányászati iparban.
az ammónium-nitrátot zárt műanyag zacskóban tárolják, amelyet víz vesz körül. A zsák feldobásakor az ammónium-nitrát vízzel érintkezik és feloldódik.
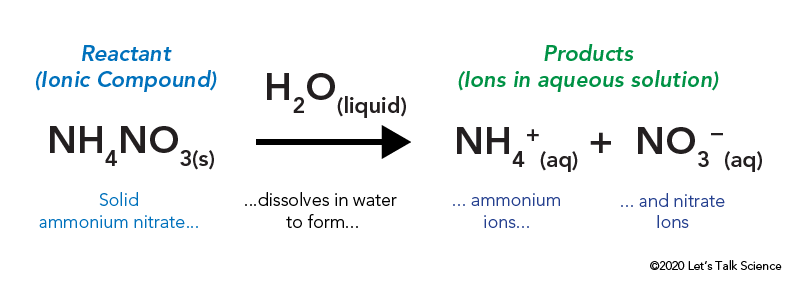
egy ionos vegyület, például asztali só vagy ammónium-nitrát feloldása energiát jelent. Más típusú reakciókhoz hasonlóan a hőenergiát is ki lehet adni vagy be lehet venni, amikor az anyag feloldódik. Ezt az energiát a megoldás energiájának nevezik, ΔHsoln néven írható.
ΔHsoln = δ ΔH – ∑ΔH
ahelyett, hogy a ΔH-t a kötési energiákat használó reagensek és termékek esetében dolgoznák ki, a tudósok gyakran előre kiszámított értékeket használnak a képződés Standard Entalpiáján (ΔH°F) táblázatok., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
számoljuk ki a megoldás energiáját
ΔHsoln = δ ΔH – ∑ΔH
= –
= –
= –
= – 339.4 + 365.1
= 25,7 kj
az elején azt mondtuk, hogy ha δh negatív, akkor a reakció exoterm, és ha δh pozitív, akkor a reakció endoterm? Nos, ez vonatkozik a megoldási problémák energiájára is. Mivel kiszámítottuk, hogy a ΔHsoln pozitív (25,7 kJ), a reakciónak endotermnek kell lennie. Tudjuk, hogy ez igaz, mert a hideg csomag nagyon hidegvé tette a környezetét!,
Összefoglalás…
az exoterm és endoterm reakciók fontosak kémiai világunk számára. Ezek a reakciók segíthetnek melegen tartani minket azáltal, hogy energiát (exoterm) bocsátanak ki, vagy segítenek lehűteni minket az energia (endoterm) bevitelével.
