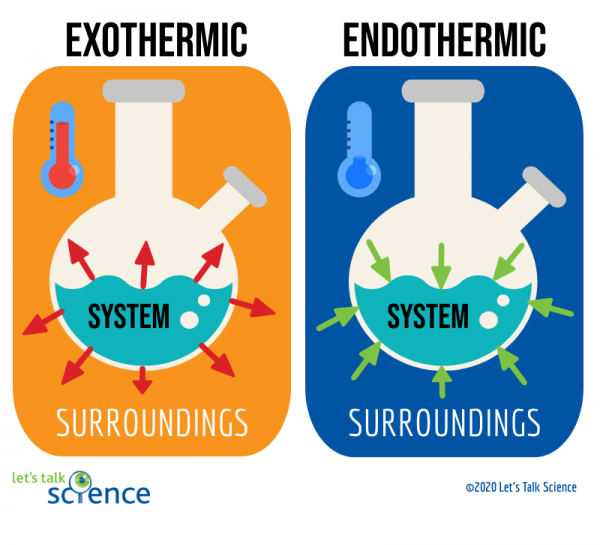
Has this ever happened to you? Estás a correr na aula de ginástica e torces o tornozelo. Dói e começa a inchar. O teu professor pega no estojo de primeiros socorros e tira um pacote Frio Instantâneo. Depois de um bom aperto, a alcateia fica muito fria, quase instantaneamente. O que se passa? Como é que os químicos fazem a embalagem arrefecer tão depressa? A resposta pode ser encontrada na termodinâmica! Este é um ramo da ciência que explora a transferência de energia., Em termodinâmica, reações químicas podem ser classificadas como endotérmicas ou exotérmicas. quais são os dois principais tipos de reações termodinâmicas?as reacções exotérmicas são reacções que libertam energia sob a forma de calor. Você provavelmente está familiarizado com muitos exemplos dessas reações. Por exemplo, queimar gasolina no motor de um carro é uma reação exotérmica. Este tipo particular de reação exotérmica é conhecido como uma reação de combustão., Uma reação de combustão ocorre quando um composto, como os hidrocarbonetos que compõem o combustível, reagem com oxigênio para formar um novo produto e produzir calor. as reacções endotérmicas são o oposto das reacções exotérmicas. Absorvem energia térmica do seu entorno. Isto significa que os arredores das reações endotérmicas são mais frios como resultado da reação. O gelo derretido é um exemplo deste tipo de reação.como você sabe que tipo de reação termodinâmica está acontecendo?
uma maneira de fazer isso é olhando para o sistema e arredores de uma reação., O sistema é onde a reação ocorre, e os arredores são a área em torno do sistema.
Para determinar se uma reação é exotérmica ou endothermic, você pode:
- medir a variação de temperatura do sistema ou de seus arredores, ou
- calcular a energia do sistema.
destes dois métodos, medir a mudança de temperatura é mais fácil. Para fazer isso, você simplesmente mede a temperatura de uma reação antes e depois que ela é concluída., Uma vez que às vezes pode ser difícil medir a temperatura dentro do sistema de uma reação, os cientistas muitas vezes medem a temperatura do ambiente ao invés disso.
é possível prever se uma reação será endotérmica ou exotérmica fazendo um pouco de matemática. Para isso, ajuda a saber um pouco sobre reações químicas e ligações químicas.,existem dois lados para qualquer reacção química. De um lado estão os reagentes. Um reagente é a substância (ou substâncias) com a qual você começa. Do outro lado estão os produtos. Um produto é a substância, ou substâncias, que você acaba com após a reação acontecer.
em uma reação química, as ligações químicas nas moléculas reagentes são quebradas. Novas ligações são formadas nas moléculas do produto. Um exemplo seria a reação de combustão entre metano (CH4) Oxigênio (O2) (os reagentes) que produz dióxido de carbono (CO2) e água (H20) moléculas (os produtos)., As ligações estão quebradas nas moléculas de metano e oxigénio. As ligações são formadas nas moléculas de dióxido de carbono e água.
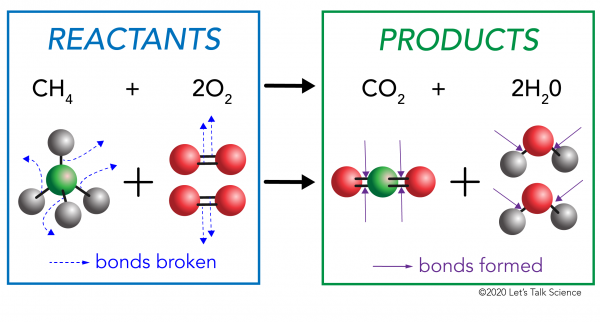
o que é importante saber é que a energia é necessária para fazer e quebrar ligações., Para determinar se uma reação é exotérmica ou endothermic, você tem que comparar a quantidade de energia necessária para quebrar as ligações dos reagentes para a quantidade de energia liberada quando novas ligações são feitas. Se a quantidade de energia liberada quando as novas ligações são formadas nos produtos é maior, então é uma reação exotérmica. Se a quantidade de energia necessária para quebrar as ligações dos reagentes é maior, então é uma reação endotérmica.
uma maneira de mostrar isto é usando um diagrama de energia. Diagramas de energia mostram os níveis de energia dos reagentes e produtos em uma reação.,
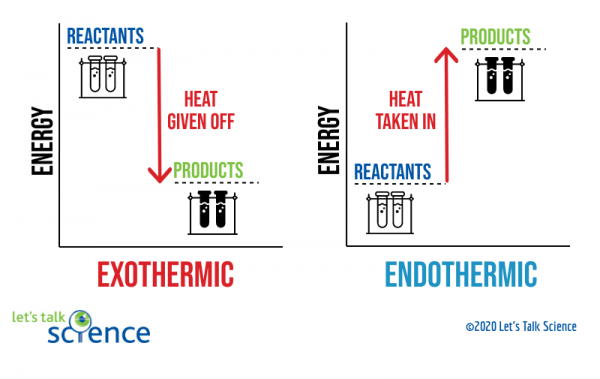
pode ver no diagrama acima que o nível de energia dos produtos de uma reacção exotérmica é inferior ao nível de energia dos reagentes. A diferença entre os níveis de energia dos reagentes e produtos é chamada de mudança de entalpia (ΔH). Em uma reação exotérmica, o ΔH é negativo. Em uma reação endotérmica, o ΔH é positivo.,
você sabia?os cientistas podem medir a energia nos alimentos medindo a quantidade de calor que os alimentos libertam quando são queimados. Eles medem isto usando uma ferramenta chamada calorímetro de bomba.
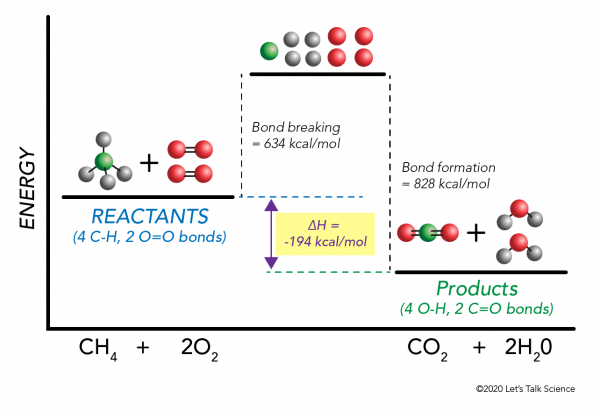
é possível calcular ΔH sem mesmo fazer um experimento! Os cientistas determinaram experimentalmente as energias necessárias para fazer e quebrar ligações moleculares específicas. Estas energias são conhecidas como energias de ligação médias.,r>
Usando a combustão de metano exemplo, novamente, a matemática funciona assim:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
Desde a mudança de entalpia é negativa, sabemos que a reação ser exotérmica.,
como funciona a termodinâmica numa embalagem fria?agora, vamos voltar à nossa embalagem instantânea de frio. Um pacote Frio Instantâneo é o exemplo perfeito de uma reação endotérmica. Há muitos ingredientes possíveis em uma embalagem fria instantânea, mas muitas vezes contêm nitrato de amônio sólido e água.
você sabia?, o nitrato de amónio é um sal nitrato de amónio. É fortemente usado na agricultura como fertilizante. Ele também é usado como um explosivo na indústria de mineração.
você sabia?, o nitrato de amónio é um sal nitrato de amónio. É fortemente usado na agricultura como fertilizante. Ele também é usado como um explosivo na indústria de mineração.
o nitrato de amónio é armazenado num saco de plástico selado rodeado de água. Quando se abre o saco, O nitrato de amónio entra em contacto com água e dissolve-se.
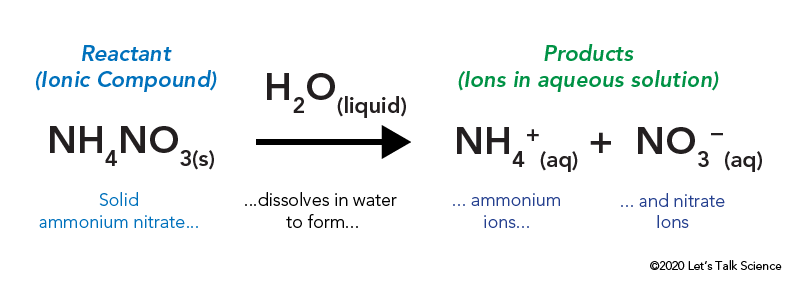
dissolver um composto iónico, como o sal de mesa ou o nitrato de amónio, envolve energia. Tal como outros tipos de reacções, a energia térmica pode ser libertada ou absorvida quando o material se dissolve. Esta energia é chamada de energia da solução e pode ser escrita como ΔHsoln.
ΔHsoln = ∑ΔH – ∑ΔH
em vez de calcular o ΔH para os reagentes e produtos que utilizam energias de ligação, os cientistas utilizam frequentemente valores pré-calculados na entalpia-padrão da formação (ΔH°f) tabelas., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
Vamos fazer o cálculo para calcular a energia de solução
ΔHsoln = ∑ΔH – ∑ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 kJ
Lembre-se que no início dissemos que se ΔH é NEGATIVO, a reação é exotérmica e que se ΔH é POSITIVO a reação é endothermic? Bem, isso também se aplica à energia de problemas de solução. Uma vez que calculamos que o ΔHsoln era positivo (25,7 kJ), a reação deve ser endotérmica. Sabemos que isto é verdade porque a alcateia fria fez o ambiente muito frio!,
