¿te ha pasado esto alguna vez? Estás corriendo en clase de gimnasia y te tuerces el tobillo. Duele y empieza a hincharse. Tu maestro toma el botiquín de primeros auxilios y saca una compresa fría instantánea. Después de un buen apretón, la mochila se enfría mucho, casi al instante. ¿Qué está pasando? ¿Cómo los químicos hacen que el paquete se enfríe tan rápido? La respuesta se puede encontrar en termodinámica! Esta es una rama de la ciencia que explora la transferencia de energía., En termodinámica, las reacciones químicas se pueden clasificar como endotérmicas o exotérmicas.
¿cuáles son los dos tipos principales de reacciones termodinámicas?
Las reacciones exotérmicas son reacciones que liberan energía en forma de calor. Probablemente esté familiarizado con muchos ejemplos de estas reacciones. Por ejemplo, quemar gasolina en el motor de un automóvil es una reacción exotérmica. Este tipo particular de reacción exotérmica se conoce como reacción de combustión., Una reacción de combustión ocurre cuando un compuesto, como los hidrocarburos que componen el combustible, reacciona con el oxígeno para formar un nuevo producto y producir calor.
Las reacciones endotérmicas son lo opuesto a las reacciones exotérmicas. Absorben la energía térmica de su entorno. Esto significa que los alrededores de las reacciones endotérmicas son más fríos como resultado de la reacción. El derretimiento del hielo es un ejemplo de este tipo de reacción.
¿Cómo sabes qué tipo de reacción termodinámica está ocurriendo?
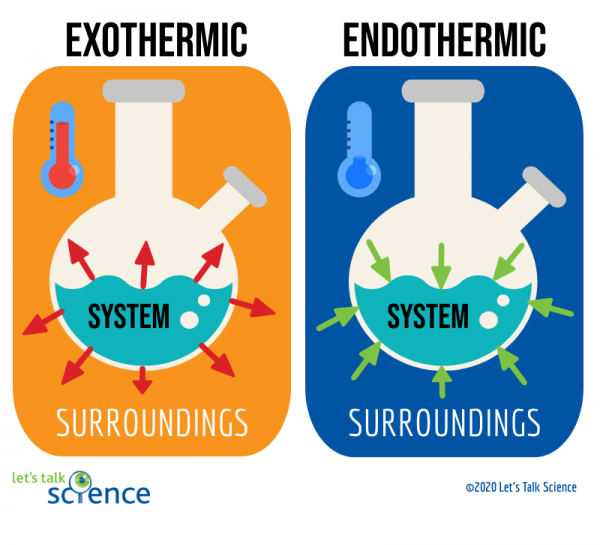
Una forma de hacer esto es mirando el sistema y el entorno de una reacción., El sistema es donde tiene lugar la reacción, y los alrededores son el área alrededor del sistema.
Para determinar si una reacción es exotérmica o endotérmica, usted podría:
- medir el cambio de temperatura del sistema o sus alrededores, o
- calcular la energía del sistema.
de estos dos métodos, medir el cambio de temperatura es más fácil. Para hacer esto, simplemente mide la temperatura de una reacción antes y después de que se complete., Dado que a veces puede ser difícil medir la temperatura dentro del sistema de una reacción, los científicos a menudo miden la temperatura del entorno en su lugar.
es posible predecir si una reacción será endotérmica o exotérmica haciendo un poco de matemáticas. Para esto, ayuda saber un poco sobre las reacciones químicas y los enlaces químicos.,
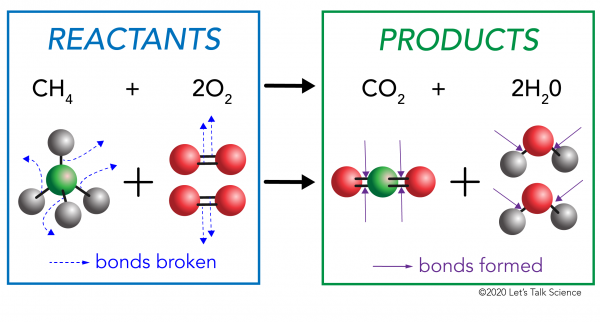
Hay dos lados en cualquier reacción química. Por un lado están los reactivos. Un reactivo es la sustancia (o sustancias) con la que se empieza. En el otro lado están los productos. Un producto es la sustancia, o sustancias, que usted termina con después de que ocurre la reacción.
en una reacción química, los enlaces químicos en las moléculas del reactivo se rompen. Se forman nuevos enlaces en las moléculas del producto. Un ejemplo sería la reacción de combustión entre metano (CH4) oxígeno (O2) (los reactivos) que produce dióxido de Carbono (CO2) y moléculas de agua (H20) (los productos)., Los enlaces se rompen en las moléculas de metano y oxígeno. Los enlaces se forman en las moléculas de dióxido de carbono y agua.
lo que es importante saber es que la energía es necesaria tanto para hacer como para romper enlaces., Para determinar si una reacción es exotérmica o endotérmica, debe comparar la cantidad de energía necesaria para romper los enlaces de los reactivos con la cantidad de energía liberada cuando se crean nuevos enlaces. Si la cantidad de energía liberada cuando se forman los nuevos enlaces en los productos es mayor, entonces es una reacción exotérmica. Si la cantidad de energía necesaria para romper los enlaces de los reactivos es mayor, entonces es una reacción endotérmica.
una forma de mostrar esto es usando un diagrama de energía. Los diagramas de energía muestran los niveles de energía de los reactivos y productos en una reacción.,
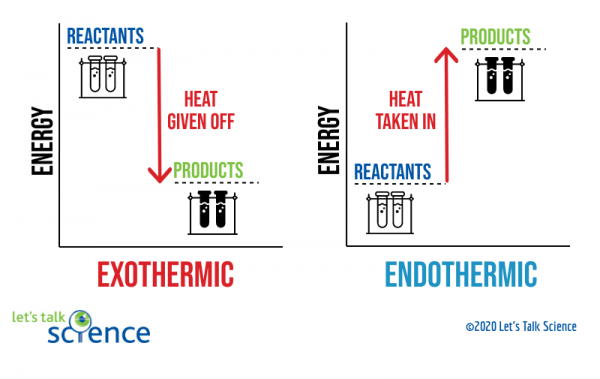
puede ver en el diagrama de arriba que el nivel de energía de los productos de una reacción exotérmica es menor que el nivel de energía de los reactivos. La diferencia entre los niveles de energía de los reactivos y los productos se denomina cambio de entalpía (ΔH). En una reacción exotérmica, la ΔH es negativa. En una reacción endotérmica, el ΔH es positivo.,
¿sabía usted?
Los científicos pueden medir la energía en los alimentos midiendo cuánto calor libera el alimento cuando se quema. Miden esto usando una herramienta llamada calorímetro de bomba.
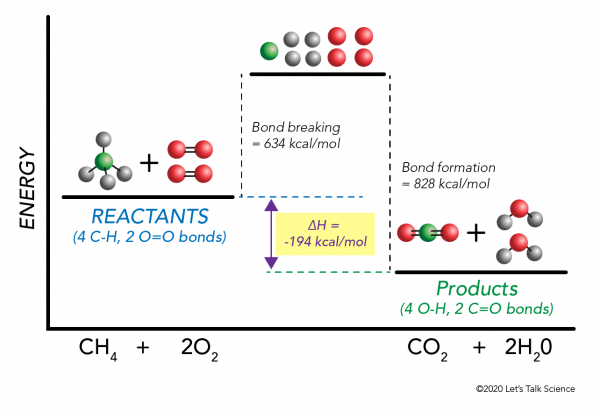
es posible calcular ΔH sin siquiera hacer un experimento! Los científicos han determinado experimentalmente las energías necesarias para crear y romper enlaces moleculares específicos. Estas energías se conocen como energías de enlace promedio.,r>
el Uso de la combustión de metano ejemplo de nuevo, la matemática trabaja como esto:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
a partir de la variación de entalpía es negativa, sabemos que la reacción será exotérmica.,
¿cómo funciona la termodinámica en una compresa fría?
ahora, volvamos a nuestra compresa fría instantánea. Una compresa fría instantánea es el ejemplo perfecto de una reacción endotérmica. Hay muchos ingredientes posibles en una compresa fría instantánea, pero a menudo contienen nitrato de amonio sólido y agua.
¿sabía usted?,
El nitrato de amonio es una sal de nitrato. Es muy utilizado en la agricultura como fertilizante. También se utiliza como explosivo en la industria minera.
El nitrato de amonio se almacena en una bolsa de plástico sellada que está rodeada de agua. Cuando se abre la bolsa, el nitrato de amonio entra en contacto con el agua y se disuelve.
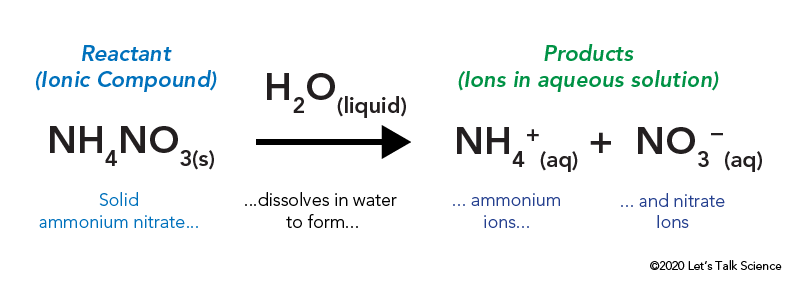
disolver un compuesto iónico, como la sal de mesa o el nitrato de amonio, implica energía. Al igual que otros tipos de reacciones, la energía térmica puede ser emitida o absorbida cuando el material se disuelve. Esta energía se llama la energía de la solución y se puede escribir como ΔHsoln.
ΔHsoln = ∑ΔH – ∑ΔH
en lugar de calcular el ΔH para los reactivos y productos utilizando energías de enlace, los científicos a menudo utilizan valores pre-calculados en tablas estándar de entalpía de formación (ΔH°f)., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
Vamos a realizar los cálculos para calcular la energía de la solución
ΔHsoln = ∑ΔH – ∑ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 kJ
Recuerde que en el principio se nos dijo que si ΔH es NEGATIVO, la reacción es exotérmica y que si ΔH es POSITIVA, la reacción es endotérmica? Bueno, eso también se aplica a la energía de los problemas de solución. Dado que calculamos que el ΔHsoln era positivo (25,7 kJ), la reacción debe ser endotérmica. Sabemos que esto es cierto porque la compresa fría hizo que su entorno fuera muy frío.,
resumiendo…
Las reacciones exotérmicas y endotérmicas son importantes para nuestro mundo químico. Estas reacciones pueden ayudarnos a mantenernos calientes al emitir energía (exotérmica) o ayudar a enfriarnos al tomar energía (endotérmica).
