– Onko tämä koskaan tapahtunut sinulle? Juokset liikuntatunnilla ja nyrjäytät nilkkaasi. Se sattuu ja alkaa turvota. Opettajasi nappaa ensiapulaukun ja vetää heti kylmälaukun. Yhden hyvän puristuksen jälkeen pakki muuttuu todella kylmäksi, melkein heti. Mitä tapahtuu? Miten kemikaalit tekevät pakkauksesta kylmän niin nopeasti? Vastaus löytyy termodynamiikasta! Tämä on tieteen haara, joka tutkii energian siirtoa., Termodynamiikan, kemialliset reaktiot voidaan luokitella joko endoterminen tai eksoterminen.
mitkä ovat termodynaamisten reaktioiden kaksi päätyyppiä?
Eksoterminen reaktioita, jotka vapauttavat energiaa lämmön muodossa. Tunnet luultavasti monia esimerkkejä näistä reaktioista. Esimerkiksi bensiinin polttaminen auton moottorissa on eksoterminen reaktio. Tämä eksoterminen reaktio tunnetaan palamisreaktiona., Palamisen reaktio tapahtuu, kun yhdiste, kuten hiilivetyjä, jotka muodostavat polttoaine reagoi hapen kanssa muodostaen uuden tuotteen ja tuottaa lämpöä.
Endotermiset reaktiot ovat eksotermisten reaktioiden vastakohta. Ne imevät ympäristöstään lämpöenergiaa. Tämä tarkoittaa, että endotermisten reaktioiden ympäristö on kylmempi reaktion seurauksena. Jään sulaminen on esimerkki tällaisesta reaktiosta.
Mistä tiedät, minkälainen termodynaaminen reaktio on tapahtumassa?
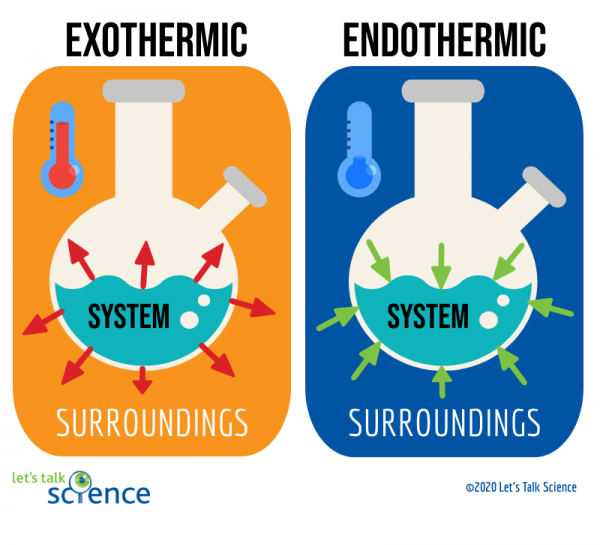
yksi tapa tehdä tämä on tarkastella reaktion järjestelmää ja ympäristöä., Järjestelmä, jossa reaktio tapahtuu, ja ympäristö on ympärillä järjestelmä.
määrittää, jos reaktio on eksoterminen tai endoterminen, voit:
- mittaa lämpötilan muutos järjestelmään tai sen ympäristössä, tai
- laske systeemin energiaa.
näistä kahdesta menetelmästä lämpötilan muutoksen mittaaminen on helpompaa. Voit tehdä tämän yksinkertaisesti mitata reaktion lämpötilan ennen ja jälkeen sen valmistumisen., Koska se voi joskus olla vaikea mitata lämpötilaa järjestelmän sisällä reaktio, tutkijat usein mitata lämpötilaa ympäristön sijaan.
on mahdollista ennustaa, onko reaktio on endoterminen tai eksoterminen tekemällä hieman matematiikkaa. Tätä varten se auttaa tietämään hieman kemiallisista reaktioista ja kemiallisista sidoksista.,
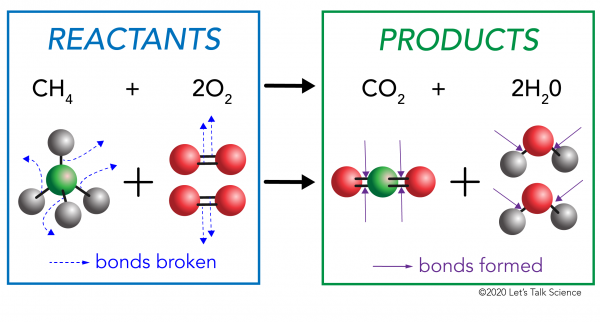
kemiallisella reaktiolla on kaksi puolta. Toisella puolella ovat reaktantit. Reaktantti on alkuaine (tai aineet). Toisella puolella ovat tuotteet. Tuote on aine eli aineet, joihin päädytään reaktion tapahduttua.
kemiallisessa reaktiossa reaktanttimolekyylien kemialliset sidokset rikkoutuvat. Tuotemolekyyleihin muodostuu uusia sidoksia. Esimerkki olisi palaminen reaktio välillä, metaani (CH4), happi (O2) (reagenssit), joka tuottaa hiilidioksidia (CO2) ja vettä (H20) molekyylit (tuotteet)., Sidokset hajoavat metaani-ja happimolekyyleissä. Sidoksia muodostuu hiilidioksidi-ja vesimolekyyleissä.
Mitä on tärkeää tietää, on se, että energiaa tarvitaan sekä tehdä ja rikkoa joukkovelkakirjat., Määrittää, jos reaktio on eksoterminen tai endoterminen, sinun täytyy verrata määrä energiaa tarvitaan rikkoa joukkovelkakirjojen reagenssit määrä energiaa vapautuu, kun uusia joukkovelkakirjalainoja on tehty. Jos uusien sidosten muodostuessa tuotteissa vapautuva energiamäärä on suurempi, kyseessä on eksoterminen reaktio. Jos reaktanttien sidosten katkaisemiseen tarvittava energiamäärä on suurempi, kyseessä on endoterminen reaktio.
yksi tapa osoittaa tämä on käyttää energiakaaviota. Energiakaavioissa näkyvät reaktanttien ja tuotteiden energiatasot reaktiossa.,
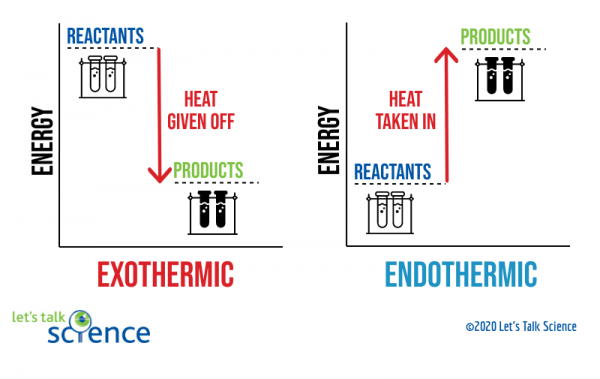
voitte nähdä kaavion yläpuolella, että energia taso tuotteet eksoterminen reaktio on pienempi kuin energian taso reagenssit. Ero energian tasoilla reagenssit ja tuotteita kutsutaan entalpia muutos (ΔH). Eksotermisessä reaktiossa ΔH on negatiivinen. Endotermisessä reaktiossa ΔH on positiivinen.,
tiesitkö?
tutkijat voivat mitata ruoan energiaa mittaamalla, kuinka paljon lämpöä ruoka vapautuu poltettaessa. Tätä mitataan pommikalorimetriksi kutsutulla työkalulla.
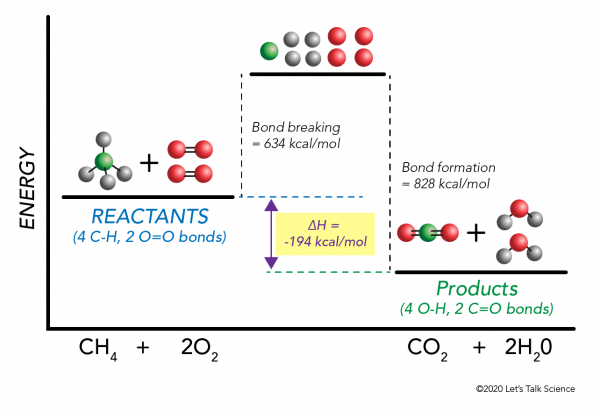
on mahdollista laskea ΔH tekemättä kokeilu! Tutkijat ovat määrittäneet kokeellisesti energiat, joita tarvitaan tiettyjen molekyylisidosten tekemiseen ja katkaisemiseen. Nämä energiat tunnetaan keskimääräisinä sidosenergioina.,r>
Käyttää metaanin palaminen esimerkki taas, että matematiikka toimii näin:
ΔH = –
=,
=,
=,
= 634 – 828
– = – 194 kcal/mol
Koska entalpia muutos on negatiivinen, me tiedämme, että reaktio on eksoterminen.,
Miten termodynamiikan työtä kylmä pakkaus?
Now, let ’ s go back to our instant cold pack. Välitön kylmäpakkaus on täydellinen esimerkki endotermisestä reaktiosta. Välittömässä kylmäpakkauksessa on monia mahdollisia ainesosia, mutta ne sisältävät usein kiinteää ammoniumnitraattia ja vettä.
tiesitkö?,
ammoniumnitraatti on nitraattisuola. Sitä käytetään maataloudessa runsaasti lannoitteena. Sitä käytetään myös räjähteenä kaivosteollisuudessa.
ammoniumnitraatti varastoidaan tiiviiseen muovipussiin, joka on veden ympäröimä. Pussissa ammoniumnitraatti joutuu kosketuksiin veden kanssa ja liukenee.
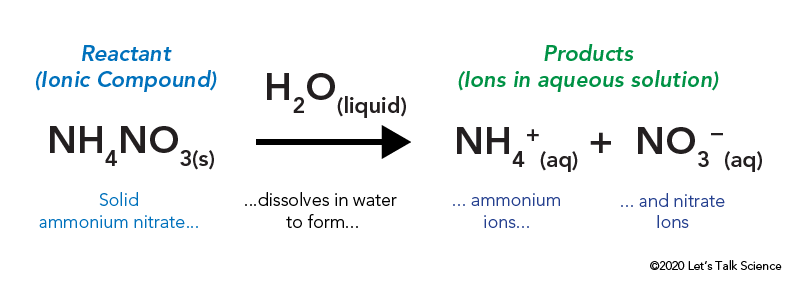
Liuottamalla ioninen yhdiste, kuten ruokasuolaa tai ammoniumnitraatti, joka sisältää energiaa. Kuten muunlaiset reaktiot, lämpöenergia voidaan luovuttaa pois tai ottaa, kun materiaali liukenee. Tätä energiaa kutsutaan liuoksen energiaksi ja se voidaan kirjoittaa Δhsolniksi.
ΔHsoln = ∑ΔH – ∑ΔH
sen Sijaan, että pyrkii pois ΔH varten reagenssit ja tuotteita käyttämällä bond energialähteet, tutkijat usein käyttää valmiiksi laskettuja arvoja Vakio Entalpia muodostumista (ΔH°f) taulukoita., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
tehdään matematiikka laskea energian ratkaisu,
ΔHsoln = ∑ΔH – ∑ΔH
=,
=,
– = – 339.4 + 365.1
= 25.7 kJ
Muista alussa me sanoi, että jos ΔH on NEGATIIVINEN reaktio on eksoterminen ja että jos ΔH on POSITIIVINEN, reaktio on endoterminen? Se koskee myös ratkaisuongelmien energiaa. Koska laskimme, että ΔHsoln oli positiivinen (25,7 kJ), reaktion on oltava endoterminen. Tiedämme tämän olevan totta, koska kylmälauma teki ympäristöstään hyvin kylmän!,
tiivisti…
Eksotermiset ja endotermiset reaktiot ovat tärkeitä kemialliselle maailmallemme. Nämä reaktiot voivat auttaa meitä pitämään meidät lämpiminä antamalla energiaa (eksoterminen) tai auttaa jäähdyttämään meitä ottamalla energiaa (endoterminen).
