er dette nogensinde sket med dig? Du løber i gymnastiksalen, og du vrider din ankel. Det gør ondt og begynder at svulme op. Din lærer griber førstehjælpskassen og trækker en øjeblikkelig kold pakke ud. Efter en god klemme bliver pakken virkelig kold, næsten øjeblikkeligt. Hvad sker der? Hvordan gør kemikalierne pakken kold så hurtigt? Svaret findes i termodynamik! Dette er en gren af videnskab, der udforsker overførsel af energi., I termodynamik kan kemiske reaktioner klassificeres som enten endoterm eller eksoterm.
Hvad er de to hovedtyper af termodynamiske reaktioner?
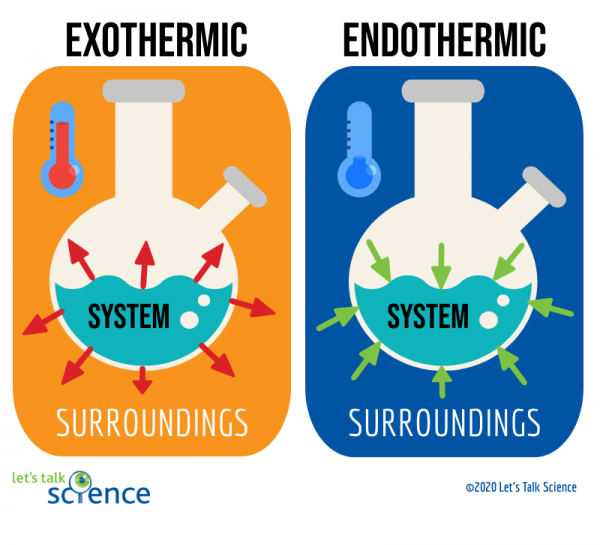
eksoterme reaktioner er reaktioner, der frigiver energi i form af varme. Du er sikkert bekendt med mange eksempler på disse reaktioner. For eksempel er brændende ben .in i en bils motor en eksoterm reaktion. Denne særlige type eksoterm reaktion er kendt som en forbrændingsreaktion., En forbrændingsreaktion opstår, når en forbindelse, såsom de kulbrinter, der udgør brændstof, reagerer med ilt for at danne et nyt produkt og producere varme.
endoterme reaktioner er det modsatte af eksoterme reaktioner. De absorberer varmeenergi fra deres omgivelser. Dette betyder, at omgivelserne af endoterme reaktioner er koldere som følge af reaktionen. Smeltende is er et eksempel på denne type reaktion.
Hvordan ved du, hvilken type termodynamisk reaktion der sker?
en måde at gøre dette på er ved at se på systemet og omgivelserne i en reaktion., Systemet er hvor reaktionen finder sted, og omgivelserne er området omkring systemet.
for at afgøre, om en reaktion er eksoterm eller endoterm, kan du:
- måle temperaturændringen af systemet eller dets omgivelser, eller
- beregne systemets energi.
af disse to metoder er måling af temperaturændringen lettere. For at gøre dette måler du blot temperaturen på en reaktion før og efter den er afsluttet., Da det undertiden kan være vanskeligt at måle temperaturen i reaktionssystemet, måler forskere ofte temperaturen i omgivelserne i stedet.
det er muligt at forudsige, om en reaktion vil være endoterm eller eksoterm ved at lave lidt matematik. Til dette hjælper det med at vide lidt om kemiske reaktioner og kemiske bindinger.,
Der er to sider til enhver kemisk reaktion. På den ene side er reaktanterne. Et reaktant er det stof (eller stoffer), du starter med. På den anden side er produkterne. Et produkt er det stof, eller stoffer, som du ender med efter reaktionen sker.
i en kemisk reaktion brydes de kemiske bindinger i reaktantmolekylerne. Nye bindinger dannes i produktmolekylerne. Et eksempel ville være forbrændingsreaktionen mellem methan (CH4) o .ygen (O2) (reaktanterne), der producerer kuldio .id (CO2) og vand (H20) molekyler (produkterne)., Bindinger brydes i metan-og iltmolekylerne. Bindinger dannes i kuldio .id og vandmolekyler.
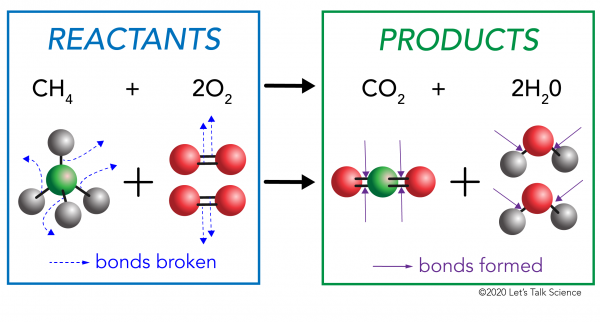
det, der er vigtigt at vide, er, at energi er nødvendig for både at skabe og bryde obligationer., For at afgøre, om en reaktion er eksoterm eller endoterm, skal du sammenligne den mængde energi, der er nødvendig for at bryde reaktanternes bindinger, med den mængde energi, der frigives, når der laves nye bindinger. Hvis mængden af energi frigivet, når de nye bindinger dannes i produkterne, er større, så er det en eksoterm reaktion. Hvis mængden af energi, der er nødvendig for at bryde reaktanternes bindinger, er større, så er det en endoterm reaktion.
en måde at vise dette på er at bruge et energidiagram. Energi diagrammer viser energi niveauer af reaktanter og produkter i en reaktion.,
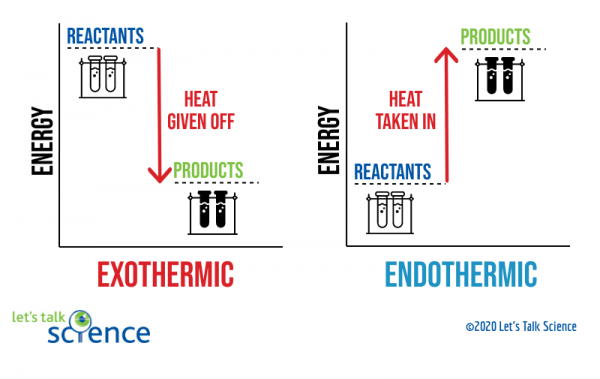
Du kan se fra diagrammet ovenfor, at energiniveauet for produkterne fra en eksoterm reaktion er lavere end reaktanternes energiniveau. Forskellen mellem energi niveauer af reaktanter og produkter kaldes enthalpi ændring (hh). I en eksoterm reaktion er NEGATIVEH negativ. I en endoterm reaktion er ΔH positiv.,
vidste du det?
forskere kan måle energi i fødevarer ved at måle, hvor meget varme fødevaren frigiver, når den brændes. De måler dette ved hjælp af et værktøj kaldet en bombe kalorimeter.
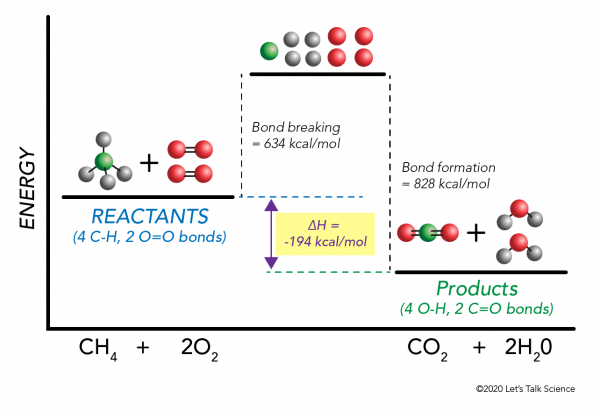
det er muligt at beregnehh uden selv at lave et eksperiment! Forskere har eksperimentelt bestemt de energier, der kræves for at fremstille og bryde specifikke molekylære bindinger. Disse energier er kendt som gennemsnitlige bindingsenergier.,r>
brug af metanforbrændingseksemplet igen fungerer matematikken sådan:
hh = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
da entalpiændringen er negativ, ved vi, at reaktionen vil være eksoterm.,
Hvordan fungerer termodynamik i en kold pakke?
lad os nu gå tilbage til vores øjeblikkelige kolde pakke. En øjeblikkelig kold pakke er det perfekte eksempel på en endoterm reaktion. Der er mange mulige ingredienser i en øjeblikkelig kold pakke, men de indeholder ofte fast ammoniumnitrat og vand.
vidste du det?,
ammoniumnitrat er et nitratsalt. Det er stærkt brugt i landbruget som gødning. Det bruges også som eksplosiv i mineindustrien.
ammoniumnitratet opbevares i en forseglet plastikpose, der er omgivet af vand. Når du popper posen, kommer ammoniumnitratet i kontakt med vand og opløses.
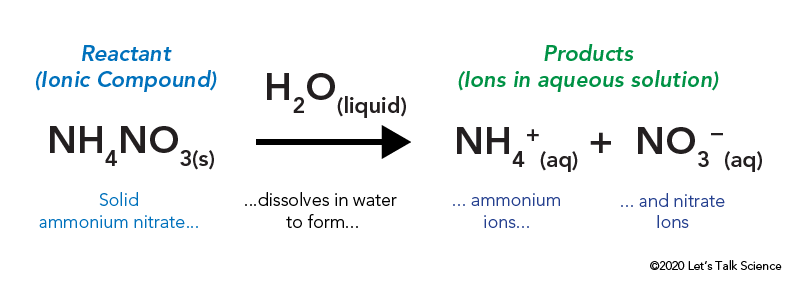
opløsning af en ionisk forbindelse, som bordsalt eller ammoniumnitrat, involverer energi. Ligesom andre typer reaktioner kan varmeenergi afgives eller indtages, når materialet opløses. Denne energi kaldes energien af løsningen og kan skrives som ΔHsoln.
soln = .hh – .hh
i stedet for at udarbejde theh for reaktanterne og produkterne ved hjælp af bond-energier, bruger forskere ofte forudberegnede værdier på standard Enthalpy of Formation (hh.f) tabeller., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
lad os gøre matematikken for at beregne energien i løsningen
Lethsoln = solutionhh – -HH
= –
= –
= – 339.4 + 365.1
= 25.7 kj
husk i begyndelsen sagde vi, at hvis negativeh er negativ, er reaktionen eksoterm, og at hvis positiveh er positiv, er reaktionen endoterm? Nå, det gælder også for energi af løsningsproblemer. Da vi beregnet, at ΔHsoln var positiv (25, 7 kJ), skal reaktionen være endoterm. Vi ved, at dette er sandt, fordi den kolde pakke gjorde sine omgivelser meget kolde!,
Opsummering…
eksoterme og endoterme reaktioner er vigtige for vores kemiske verden. Disse reaktioner kan hjælpe med at holde os varme ved at afgive energi (eksoterm) eller hjælpe med at afkøle os ved at indtage energi (endoterm).
