stalo se vám to někdy? Běžíte v tělocvičně a otočíte si kotník. Bolí to a začne bobtnat. Váš učitel popadne lékárničku a vytáhne okamžitý studený balíček. Po jednom dobrém stlačení se balení stává opravdu chladným, téměř okamžitě. Co se děje? Jak chemikálie dělají balení tak rychle? Odpověď lze nalézt v termodynamice! Jedná se o vědní obor, který zkoumá přenos energie., V termodynamice mohou být chemické reakce klasifikovány jako endotermické nebo exotermické.
jaké jsou dva hlavní typy termodynamických reakcí?
exotermické reakce jsou reakce, které uvolňují energii ve formě tepla. Pravděpodobně jste obeznámeni s mnoha příklady těchto reakcí. Například spalování benzínu v motoru automobilu je exotermická reakce. Tento konkrétní typ exotermické reakce je známý jako spalovací reakce., Reakce spalování nastává, když sloučenina, jako jsou uhlovodíky, které tvoří palivo, reagují s kyslíkem za vzniku nového produktu a produkují teplo.
endotermické reakce jsou opakem exotermických reakcí. Absorbují tepelnou energii ze svého okolí. To znamená, že okolí endotermických reakcí je v důsledku reakce chladnější. Tající LED je příkladem tohoto typu reakce.
jak víte, jaký typ termodynamické reakce se děje?
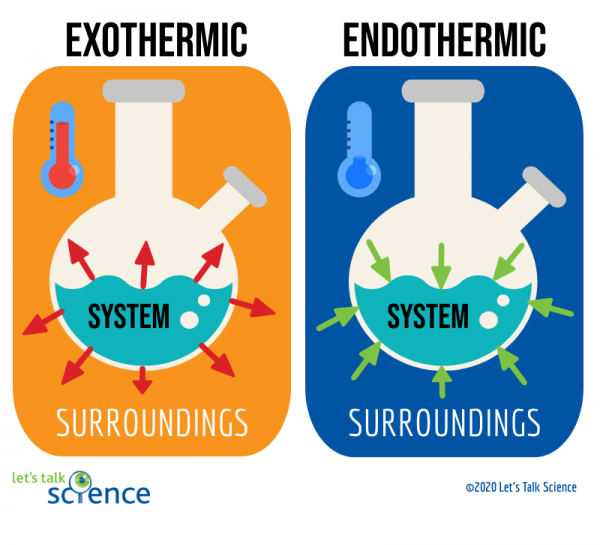
jedním ze způsobů, jak toho dosáhnout, je pohled na systém a okolí reakce., Systém je místem, kde probíhá reakce, a okolí je oblast kolem systému.
K určení, zda je reakce exotermické nebo endotermické, můžete:
- měření teploty změna systému nebo jeho okolí, nebo
- výpočet energie systému.
těchto dvou metod je měření změny teploty snazší. Chcete-li to provést, jednoduše změřte teplotu reakce před a po jejím dokončení., Protože někdy může být obtížné měřit teplotu v systému reakce, vědci místo toho často měří teplotu okolí.
je možné předvídat, zda bude reakce endotermické nebo exotermické tím, že dělá trochu matematiky. Za tímto účelem pomáhá vědět něco o chemických reakcích a chemických vazbách.,
existují dvě strany jakékoli chemické reakce. Na jedné straně jsou reaktanty. Reaktant je látka (nebo látky), se kterou začínáte. Na druhé straně jsou výrobky. Produkt je látka nebo látky, které skončíte po reakci.
při chemické reakci jsou chemické vazby v molekulách reaktantu přerušeny. V molekulách produktu se vytvářejí nové vazby. Příkladem by byla spalovací reakce mezi metanem (CH4) kyslíkem (O2) (reaktanty), který produkuje oxid uhličitý (CO2) a molekuly vody (H20) (produkty)., Vazby jsou rozděleny v molekulách metanu a kyslíku. Vazby se tvoří v molekulách oxidu uhličitého a vody.
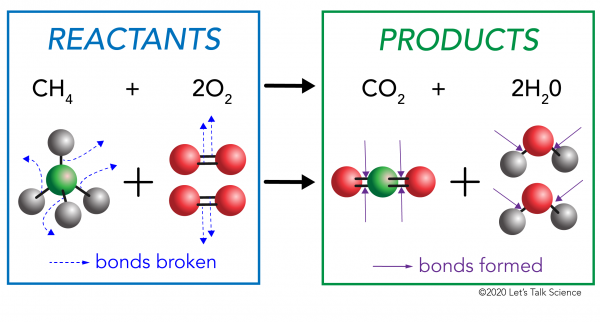
Co je důležité vědět je, že energie je potřeba na to jak udělat a rozbít dluhopisů., K určení, zda je reakce exotermické nebo endotermické, musíte porovnat množství energie potřebné k přerušení vazeb reaktantů k množství energie uvolní, když nové dluhopisy jsou vyrobeny. Pokud je množství energie uvolněné při vytváření nových vazeb v produktech větší, pak je to exotermická reakce. Pokud je množství energie potřebné k přerušení vazeb reaktantů větší, pak je to endotermická reakce.
jedním ze způsobů, jak to ukázat, je použití energetického diagramu. Energetické diagramy ukazují energetické hladiny reaktantů a produktů v reakci.,
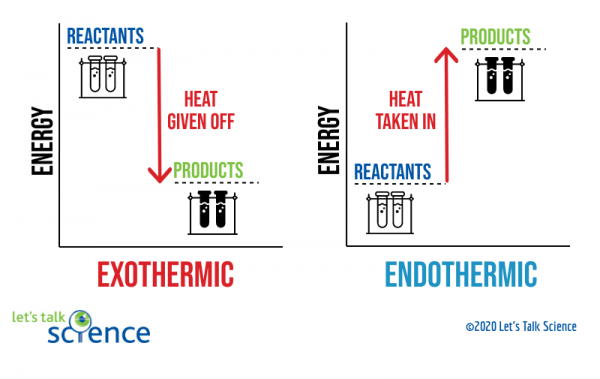
můžete vidět z obrázku výše, že úroveň energie produktů exotermická reakce je nižší než úroveň energie reaktantů. Rozdíl mezi energetickými hladinami reaktantů a produktů se nazývá entalpická změna (ΔH). Při exotermické reakci je ΔH negativní. Při endotermické reakci je ΔH pozitivní.,
věděli jste?
vědci mohou měřit energii v potravinách měřením toho, kolik tepla uvolňuje jídlo, když je spáleno. Měří to pomocí nástroje zvaného kalorimetr bomby.
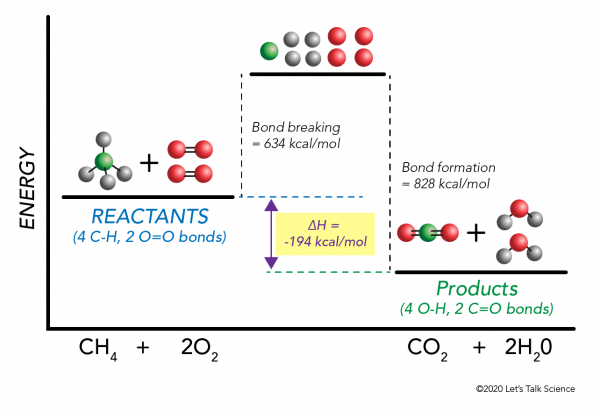
je možné vypočítat ΔH i bez experimentem! Vědci experimentálně určili energie potřebné k vytváření a rozbití specifických molekulárních vazeb. Tyto energie jsou známé jako průměrné energie vazby.,r>
Použití metanu spalování opět příklad, v matematice funguje takhle:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
Od entalpie je záporná víme, že bude reakce exotermní.,
jak funguje termodynamika ve studeném balení?
nyní se vraťme k našemu okamžitému studenému balení. Okamžité studené balení je dokonalým příkladem endotermické reakce. Existuje mnoho možných složek v okamžitém studeném balení, ale často obsahují pevný dusičnan amonný a vodu.
věděli jste?,
dusičnan amonný je dusičnanová sůl. Je silně používán v zemědělství jako hnojivo. Používá se také jako výbušnina v těžebním průmyslu.
dusičnan amonný je uložen v uzavřeném plastovém sáčku, který je obklopen vodou. Když vytáhnete sáček, dusičnan amonný přichází do styku s vodou a rozpouští se.
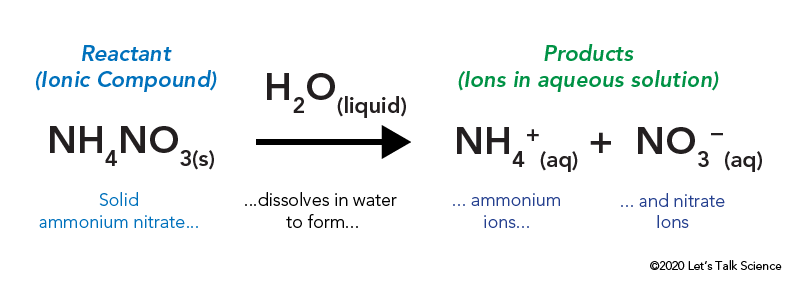
rozpouštění iontové sloučeniny, jako je stolní sůl nebo dusičnan amonný, zahrnuje energii. Stejně jako jiné typy reakcí může být tepelná energie uvolněna nebo odebrána, když se materiál rozpustí. Tato energie se nazývá energie řešení a může být napsána jako ΔHsoln.
ΔHsoln = ∑ΔH – ∑ΔH
Spíše než pracovat z ΔH pro reaktanty a produkty, které používají bond energies, vědci často používají pre-vypočtené hodnoty na Standardní Entalpie Tvorby (ΔH°f) tabulky., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
Pojďme si to spočítejte pro výpočet energie z řešení
ΔHsoln = ∑ΔH – ∑ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 kJ
vzpomeňte si na začátku jsme si řekli, že pokud ΔH je NEGATIVNÍ, reakce je exotermní a že pokud ΔH je POZITIVNÍ reakce endotermické? To platí i pro energii problémů s řešením. Protože jsme vypočítali, že ΔHsoln byl pozitivní (25,7 kJ), reakce musí být endotermická. Víme, že je to pravda, protože studená smečka způsobila, že její okolí bylo velmi chladné!,
shrnutí…
exotermické a endotermické reakce jsou důležité pro náš chemický svět. Tyto reakce nám mohou pomoci udržet nás v teple tím, že rozdávají energii (exotermickou) nebo nám pomáhají ochladit energii (endotermickou).
