Har dette noensinne skjedd med deg? Du kjører i gym klassen og du vri ankelen. Det gjør vondt og begynner å svelle opp. Læreren griper first aid kit og trekker ut en øyeblikkelig kalde pack. Etter en god klem, pakken blir veldig kaldt, nesten umiddelbart. Hva er det som skjer? Hvordan gjøre kjemikalier gjøre pack kaldt så raskt? Svaret kan bli funnet i termodynamikk! Dette er en gren av vitenskapen som undersøker overføring av energi., I termodynamikk, kjemiske reaksjoner kan bli klassifisert som enten endothermic eller eksoterme.
Hva er de to viktigste typene av termodynamiske reaksjoner?
Eksoterme reaksjoner er reaksjoner som frigjør energi i form av varme. Du er sannsynligvis kjent med mange eksempler på slike reaksjoner. For eksempel, brennende bensin i en motor er en eksoterme reaksjonen. Denne spesielle typen av eksoterme reaksjonen er kjent som en forbrenning reaksjon., Forbrenning reaksjon oppstår når et stoff, for eksempel hydrokarboner som utgjør drivstoff, reagerer med oksygen og danner et nytt produkt og produserer varme.
Endothermic reaksjoner er det motsatte av eksoterme reaksjoner. De absorberer varme energi fra sine omgivelser. Dette betyr at omgivelsene av endothermic reaksjoner er kaldere som en følge av reaksjonen. Issmeltingen er et eksempel på denne type reaksjon.
Hvordan vet du hvilken av termodynamiske reaksjon som skjer?
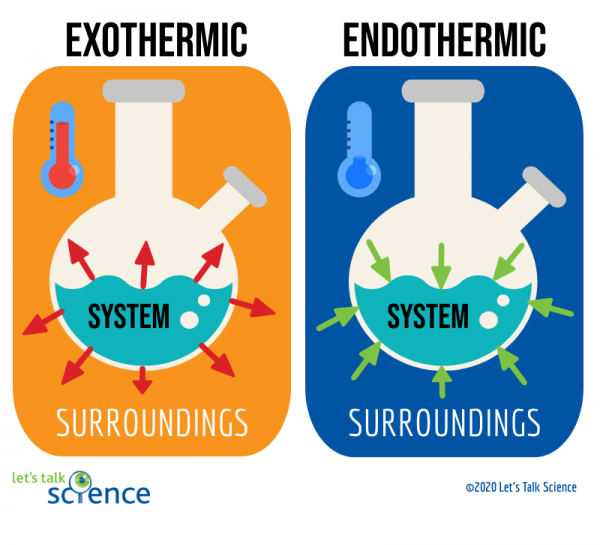
En måte å gjøre dette på er ved å se på systemet og omgivelsene på en reaksjon., Systemet er der reaksjonen foregår, og omgivelsene er området rundt systemet.
for Å finne ut om en reaksjon er eksoterme eller endothermic, kan du:
- måle temperatur endring av systemet, eller omgivelsene, eller
- beregne energien i systemet.
Av disse to metodene, som måler temperaturen endringen er enklere. For å gjøre dette, du bare måle temperaturen på en reaksjon før og etter at den er fullført., Siden det kan noen ganger være vanskelig å måle temperaturen i systemet av en reaksjon, forskere ofte måle temperaturen i omgivelsene i stedet.
Det er mulig å forutsi om en reaksjon vil være endothermic eller eksoterme ved å gjøre litt matte. For dette, det hjelper å vite litt om kjemiske reaksjoner og kjemiske forbindelser.,
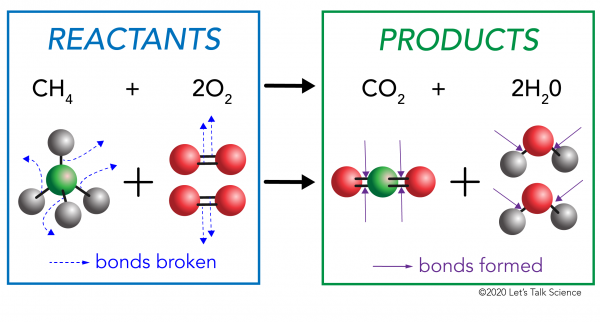
Det er to sider til enhver kjemisk reaksjon. På den ene siden er reaktantene. En reaktant er stoffet (eller stoffer) som du starter med. På den andre siden er det produkter. Et produkt er stoffet eller stoffene, at du ender opp med etter reaksjonen skjer.
I en kjemisk reaksjon, den kjemiske forbindelser i reaktant molekyler er brutt. Nye obligasjoner er dannet i produktet molekyler. Et eksempel ville være forbrenning reaksjon mellom metan (CH4) oksygen (O2) (reaktantene) som produserer karbondioksid (CO2) og vann (H20) – molekyler (produktene)., Obligasjoner er brutt i metan og oksygen molekyler. Obligasjoner er dannet karbondioksid og vann molekyler.
Det er viktig å vite er at energi er nødvendig for å både gjøre og å bryte obligasjoner., For å avgjøre om en reaksjon er eksoterme eller endothermic, du har å sammenligne mengden av energi som trengs for å bryte båndene av reaktantene til mengden energi som frigjøres når nye obligasjoner er gjort. Hvis mengden av energi som frigjøres når nye obligasjoner er dannet i produktene er større, så er det en eksoterme reaksjonen. Hvis mengden av energi som trengs for å bryte båndene av reaktantene er større, så er det en endothermic reaksjon.
En måte å vise dette på er å bruke en energi-diagram. Energi diagrammer viser energi-nivåer av reaktanter og produkter i en reaksjon.,
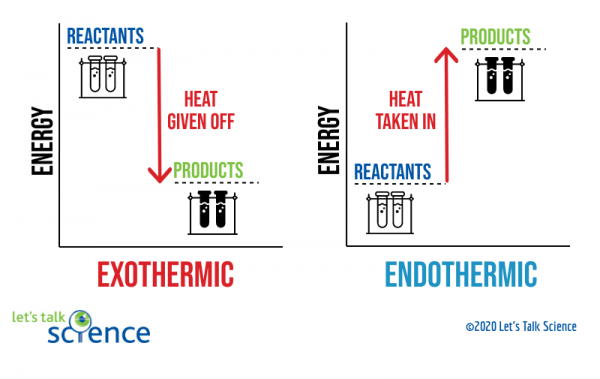
Du kan se av diagrammet over at energi nivået av produktene av en eksoterme reaksjonen er lavere enn den energi nivå av reaktantene. Forskjellen mellom energi nivåer av reaktanter og produkter er kalt entalpi endre (ΔH). I en eksoterme reaksjonen, ΔH er NEGATIVE. I en endothermic reaksjon, ΔH er POSITIVE.,
Visste du at?
Forskere kan måle energien i matvarer ved å måle hvor mye varme maten utgivelser når det er brent. De måler dette ved hjelp av et verktøy som kalles en bombe calorimeter.
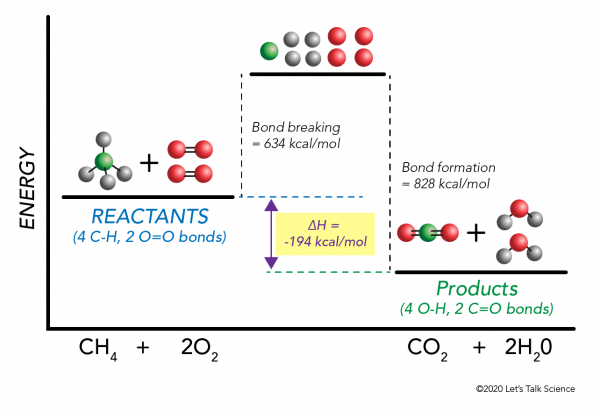
Det er mulig å beregne ΔH uten engang å gjøre et eksperiment! Forskere har bestemt eksperimentelt den energi som kreves for å inngå og bryte spesifikke molekylære obligasjoner. Disse energiene er kjent som gjennomsnittlig bond energier.,r>
ved Hjelp av metan forbrenning eksempel igjen, matematikk fungerer som dette:
ΔH = –
– >
= –
– >
= –
– >
= –
– >
= 634 – 828
= – 194 kcal/mol
Siden entalpi endringen er negative, vi vet at reaksjonen vil være eksoterme.,
Hvordan gjøre termodynamikk arbeid i en kald pakke?
Nå, la oss gå tilbake til vår chat-cold pack. En øyeblikkelig kalde pack er perfekt eksempel på en endothermic reaksjon. Det er mange mulige ingredienser i en øyeblikkelig kalde pack, men de inneholder ofte solid ammonium nitrat og vann.
Visste du at?,
Ammonium nitrat er en nitrat salt. Det er tungt brukes i landbruket som et gjødsel. Det er også brukt som en eksplosiv i gruveindustrien.
ammonium nitrat er lagret i en forseglet plastpose som er omgitt av vann. Når du pop posen, ammonium nitrat kommer i kontakt med vann og oppløses.
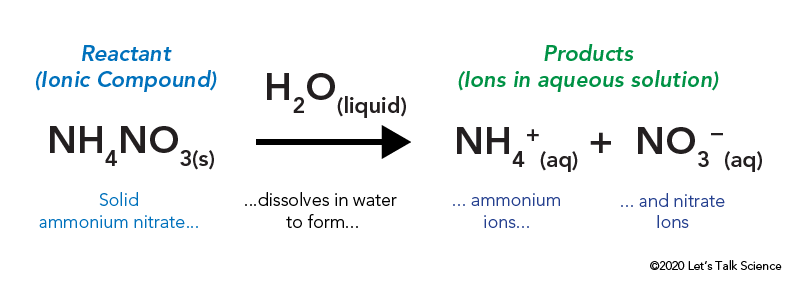
å Løse en ionisk sammensatte, som bordsalt eller ammonium nitrat, innebærer energi. Som andre typer reaksjoner, varme energi kan være gitt av eller tatt i når materialet oppløses. Denne energien kalles energi av løsning, og kan skrives som ΔHsoln.
ΔHsoln = ∑ΔH – ∑ΔH
Snarere enn å jobbe ut ΔH for reaktanter og produkter ved hjelp av bond energier, forskere ofte bruker pre-kalkulerte verdier på Standard Entalpi for Dannelse (ΔH°f) bord., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
La oss gjøre regnestykket for å beregne energi av løsningen
ΔHsoln = ∑ΔH – ∑ΔH
= –
– >
= –
– >
= – 339.4 + 365.1
= 25.7 kJ
Husk på begynnelsen sa vi at hvis ΔH er NEGATIVE reaksjonen er eksoterme og at hvis ΔH er POSITIVE reaksjonen er endothermic? Vel, det gjelder også for energi løsning av problemer. Siden vi beregnet at ΔHsoln var positiv (25.7 kJ), reaksjonen må være endothermic. Vi vet at dette er sant fordi den kalde pack laget sine omgivelser, veldig kaldt!,
Summere opp…
Eksoterme og endothermic reaksjoner er viktig for vår kjemiske verden. Disse reaksjonene kan bidra til å holde oss varme ved å gi ut energi (eksoterme) eller bidra til å kjøle oss ned ved å ta i energi (endothermic).
