Czy zdarzyło ci się to kiedyś? Biegasz na siłowni i skręcasz kostkę. Boli i zaczyna puchnąć. Twój nauczyciel chwyta apteczkę i wyciąga natychmiastowe zimne opakowanie. Po jednym dobrym ściśnięciu opakowanie staje się naprawdę zimne, niemal natychmiast. Co się dzieje? Jak chemikalia powodują, że opakowanie stygnie tak szybko? Odpowiedź można znaleźć w termodynamice! Jest to gałąź nauki, która bada transfer energii., W termodynamice reakcje chemiczne mogą być klasyfikowane jako endotermiczne lub egzotermiczne.
jakie są dwa główne rodzaje reakcji termodynamicznych?
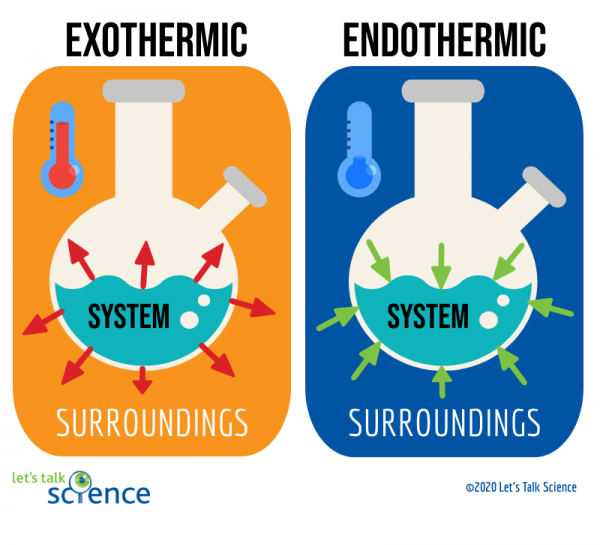
reakcje egzotermiczne to reakcje uwalniające energię w postaci ciepła. Prawdopodobnie znasz wiele przykładów tych reakcji. Na przykład spalanie benzyny w silniku samochodu jest reakcją egzotermiczną. Ten szczególny rodzaj reakcji egzotermicznej jest znany jako reakcja spalania., Reakcja spalania zachodzi, gdy związek, taki jak węglowodory, które tworzą paliwo, reaguje z tlenem, tworząc nowy produkt i wytwarzając ciepło.
reakcje endotermiczne są przeciwieństwem reakcji egzotermicznych. Pochłaniają energię cieplną z otoczenia. Oznacza to, że otoczenie reakcji endotermicznych jest zimniejsze w wyniku reakcji. Przykładem tego typu reakcji jest topnienie lodu.
skąd wiesz, jaki rodzaj reakcji termodynamicznej zachodzi?
jednym ze sposobów na to jest spojrzenie na układ i otoczenie reakcji., Układ jest miejscem, w którym zachodzi reakcja, a otoczenie jest obszarem wokół układu.
aby określić, czy reakcja jest egzotermiczna lub endotermiczna, można:
- zmierzyć zmianę temperatury układu lub jego otoczenia lub
- obliczyć energię układu.
spośród tych dwóch metod pomiar zmiany temperatury jest łatwiejszy. Aby to zrobić, wystarczy zmierzyć temperaturę reakcji przed i po jej zakończeniu., Ponieważ czasami trudno jest zmierzyć temperaturę w układzie reakcji, naukowcy często mierzą temperaturę otoczenia.
można przewidzieć, czy reakcja będzie endotermiczna lub egzotermiczna, wykonując trochę matematyki. W tym celu pomaga dowiedzieć się trochę o reakcjach chemicznych i wiązaniach chemicznych.,
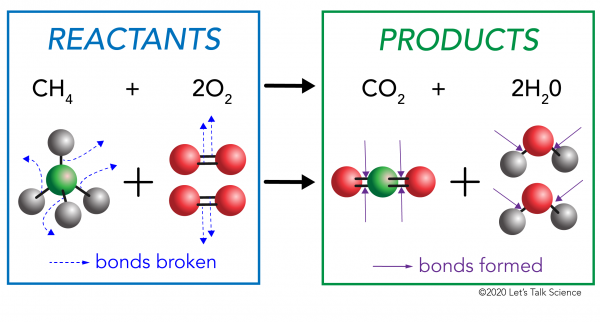
każda reakcja chemiczna ma dwie strony. Po jednej stronie są reagenty. Reagent to substancja (lub substancje), które zaczynasz. Po drugiej stronie są produkty. Produkt jest substancją lub substancjami, które kończą się po wystąpieniu reakcji.
w reakcji chemicznej wiązania chemiczne w cząsteczkach reagentów są łamane. W cząsteczkach produktu powstają nowe wiązania. Przykładem może być reakcja spalania pomiędzy metanem (CH4) tlenem (O2) (reagentami), która wytwarza dwutlenek węgla (CO2) i cząsteczki wody (H20) (produkty)., Wiązania są łamane w cząsteczkach metanu i tlenu. Wiązania powstają w cząsteczkach dwutlenku węgla i wody.
ważne jest, aby wiedzieć, że energia jest potrzebna zarówno do tworzenia, jak i do zerwania wiązań., Aby określić, czy reakcja jest egzotermiczna lub endotermiczna, trzeba porównać ilość energii potrzebnej do zerwania wiązań reagentów do ilości energii uwalnianej, gdy nowe wiązania są wykonane. Jeśli ilość energii uwalnianej podczas tworzenia nowych wiązań w produktach jest większa, to jest to reakcja egzotermiczna. Jeśli ilość energii potrzebnej do zerwania wiązań reagentów jest większa, to jest to reakcja endotermiczna.
jednym ze sposobów, aby to pokazać, jest użycie diagramu energii. Diagramy energetyczne pokazują poziomy energetyczne reagentów i produktów w reakcji.,
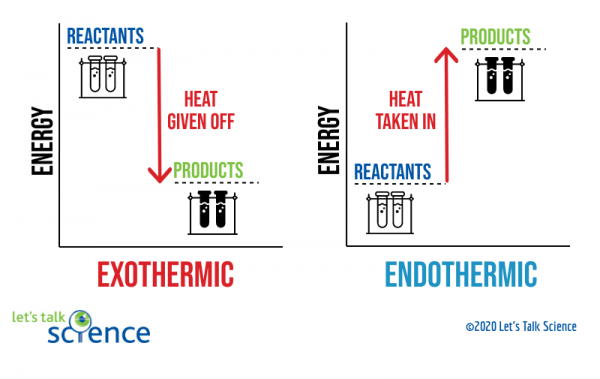
z powyższego diagramu widać, że poziom energetyczny produktów reakcji egzotermicznej jest niższy niż poziom energetyczny reagentów. Różnica między poziomami energetycznymi reagentów i produktów nazywa się zmianą entalpii (ΔH). W reakcji egzotermicznej ΔH jest ujemna. W reakcji endotermicznej ΔH jest dodatnia.,
Czy wiesz?
naukowcy mogą mierzyć energię w żywności, mierząc, ile ciepła żywność uwalnia, gdy jest spalana. Mierzą to za pomocą narzędzia zwanego kalorymetrem bombowym.
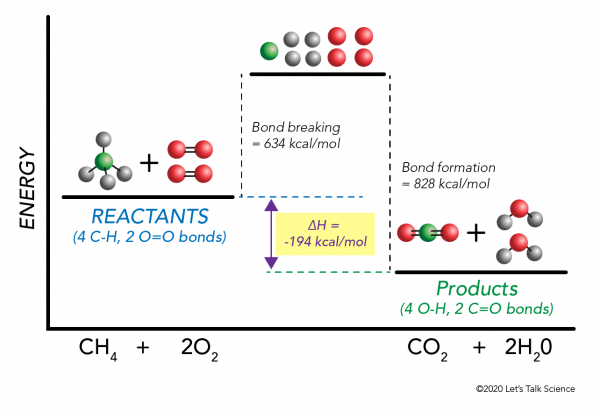
możliwe jest obliczenie ΔH nawet bez przeprowadzania eksperymentu! Naukowcy określili eksperymentalnie Energie potrzebne do tworzenia i łamania określonych wiązań molekularnych. Te energie są znane jako średnie Energie wiązania.,r>
używając ponownie przykładu spalania metanu, Matematyka działa tak:
δh = –
= –
= –
= 634 – 828
= – 194 kcal/mol
ponieważ zmiana entalpii jest ujemna, wiemy, że reakcja egzotermiczne.,
Jak działa Termodynamika w zimnym opakowaniu?
a teraz wróćmy do naszej błyskawicznej zimnej paczki. Natychmiastowe zimne opakowanie jest doskonałym przykładem reakcji endotermicznej. Istnieje wiele możliwych składników w błyskawicznym zimnym opakowaniu, ale często zawierają stały azotan amonu i wodę.
Czy wiesz?,
azotan amonu jest solą azotanową. Jest szeroko stosowany w rolnictwie jako nawóz. Jest również stosowany jako materiał wybuchowy w przemyśle wydobywczym.
azotan amonu jest przechowywany w szczelnej plastikowej torbie, która jest otoczona wodą. Po otwarciu torby azotan amonu wchodzi w kontakt z wodą i rozpuszcza się.
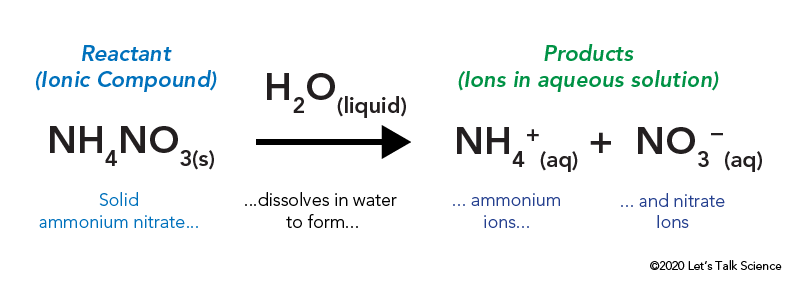
rozpuszczanie związku jonowego, takiego jak sól kuchenna lub azotan amonu, wymaga energii. Podobnie jak inne rodzaje reakcji, energia cieplna może być oddawana lub pobierana, gdy materiał się rozpuszcza. Energia ta nazywana jest energią roztworu i może być zapisana jako ΔHsoln.
ΔHsoln = δ ΔH – δ ΔH
zamiast opracowywać ΔH dla reagentów i produktów przy użyciu energii wiązania, naukowcy często używają wstępnie obliczonych wartości na standardowych tablicach entalpii formowania (ΔH°f)., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
zróbmy matematykę, aby obliczyć energię roztworu
ΔHsoln = δ ΔH – δ ΔH
= –
= –
= – 339.4 + 365.1
= 25.7 kJ
pamiętasz na początku mówiliśmy, że jeśli δh jest ujemne reakcja jest egzotermiczna i że jeśli δh jest dodatnie reakcja jest endotermiczna? Cóż, odnosi się to również do energii rozwiązywania problemów. Ponieważ obliczyliśmy, że ΔHsoln był dodatni (25,7 kJ), reakcja musi być endotermiczna. Wiemy, że to prawda, ponieważ zimny pakiet sprawił, że jego otoczenie było bardzo zimne!,
..
reakcje egzotermiczne i endotermiczne są ważne dla naszego świata chemicznego. Reakcje te mogą pomóc nam utrzymać ciepło, wydzielając energię (egzotermiczną) lub pomóc ochłodzić nas, przyjmując energię (endotermiczną).
