Ist Ihnen das jemals passiert? Sie laufen im Fitnessstudio und verdrehen Ihren Knöchel. Es tut weh und beginnt zu schwellen. Ihr Lehrer schnappt sich das Erste-Hilfe-Set und zieht eine sofortige Kühlpackung heraus. Nach einem guten Druck wird die Packung fast sofort wirklich kalt. Was passiert? Wie machen die Chemikalien die Packung so schnell kalt? Die Antwort kann in der Thermodynamik gefunden werden! Dies ist ein Wissenschaftszweig, der den Energietransfer untersucht., In der Thermodynamik können chemische Reaktionen entweder als endotherm oder exotherm klassifiziert werden.
Was sind die beiden Haupttypen thermodynamischer Reaktionen?
Exotherme Reaktionen sind Reaktionen, die Energie in form von Wärme. Sie kennen wahrscheinlich viele Beispiele für diese Reaktionen. Zum Beispiel ist das Verbrennen von Benzin im Motor eines Autos eine exotherme Reaktion. Diese besondere Art der exothermen Reaktion wird als Verbrennungsreaktion bezeichnet., Eine Verbrennungsreaktion tritt auf, wenn eine Verbindung, wie die Kohlenwasserstoffe, aus denen Kraftstoff besteht, mit Sauerstoff reagiert, um ein neues Produkt zu bilden und Wärme zu erzeugen.
Endotherme Reaktionen sind das Gegenteil von exothermen Reaktionen. Sie absorbieren Wärmeenergie aus ihrer Umgebung. Dies bedeutet, dass die Umgebung endothermer Reaktionen infolge der Reaktion kälter ist. Schmelzendes Eis ist ein Beispiel für diese Art von Reaktion.
Woher wissen Sie, welche Art von thermodynamischer Reaktion stattfindet?
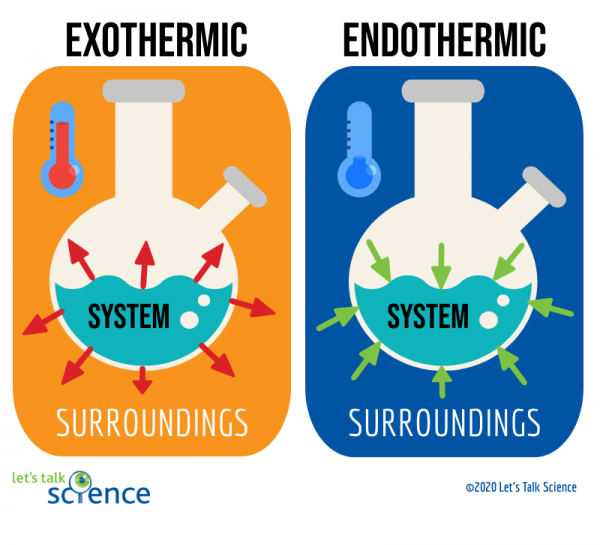
Eine Möglichkeit, dies zu tun, besteht darin, das System und die Umgebung einer Reaktion zu betrachten., Das System ist, wo die Reaktion stattfindet, und die Umgebung ist der Bereich um das System herum.
Um festzustellen, ob eine Reaktion exotherm oder endotherm ist, können Sie:
- die Temperaturänderung des Systems oder seiner Umgebung messen oder
- die Energie des Systems berechnen.
Von diesen beiden Methoden ist die Messung der Temperaturänderung einfacher. Dazu messen Sie einfach die Temperatur einer Reaktion vor und nach Abschluss., Da es manchmal schwierig sein kann, die Temperatur innerhalb des Reaktionssystems zu messen, messen Wissenschaftler häufig stattdessen die Temperatur der Umgebung.
Es ist möglich vorherzusagen, ob eine Reaktion durch ein wenig Mathematik endotherm oder exotherm sein wird. Dazu hilft es, ein wenig über chemische Reaktionen und chemische Bindungen zu wissen.,
Jede chemische Reaktion hat zwei Seiten. Auf der einen Seite sind die Reaktanten. Ein Reaktant ist die Substanz (oder Substanzen), mit der Sie beginnen. Auf der anderen Seite sind die Produkte. Ein Produkt ist die Substanz oder Substanzen, die Sie nach der Reaktion erhalten.
Bei einer chemischen Reaktion werden die chemischen Bindungen in den Reaktantenmolekülen gebrochen. In den Produktmolekülen bilden sich neue Bindungen. Ein Beispiel wäre die Verbrennungsreaktion zwischen Methan (CH4) Sauerstoff (O2) (die Reaktanten), die Kohlendioxid (CO2) und Wasser (H20) Moleküle (die Produkte) erzeugt., Bindungen werden in den Methan-und Sauerstoffmolekülen gebrochen. Bindungen werden in den Kohlendioxid-und Wassermolekülen gebildet.
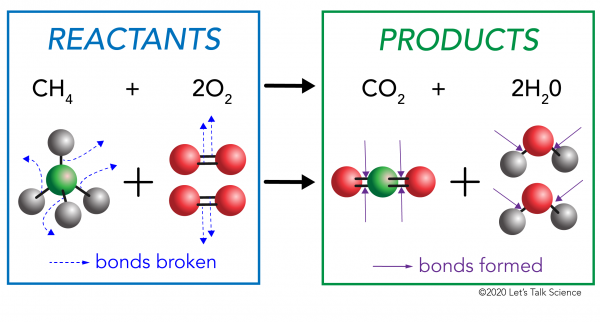
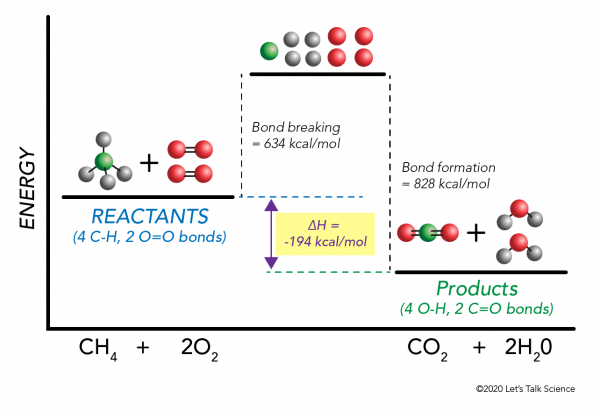
Wichtig zu wissen ist, dass Energie benötigt wird, um Bindungen herzustellen und zu brechen., Um festzustellen, ob eine Reaktion exotherm oder endotherm ist, müssen Sie die Energiemenge, die zum Brechen der Bindungen der Reaktanten benötigt wird, mit der Energiemenge vergleichen, die freigesetzt wird, wenn neue Bindungen hergestellt werden. Wenn die Menge an Energie, die freigesetzt wird, wenn die neuen Bindungen in den Produkten gebildet werden, größer ist, dann ist es eine exotherme Reaktion. Wenn die Energiemenge, die zum Brechen der Bindungen der Reaktanten benötigt wird, größer ist, handelt es sich um eine endotherme Reaktion.
Eine Möglichkeit, dies zu zeigen, ist ein Energiediagramm. Energiediagramme zeigen die Energieniveaus von Reaktanten und Produkten in einer Reaktion.,
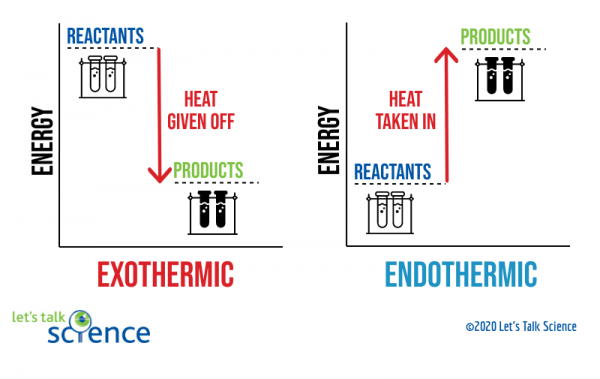
Sie können aus dem obigen Diagramm sehen, dass das Energieniveau der Produkte einer exothermen Reaktion niedriger ist als das Energieniveau der Reaktanten. Der Unterschied zwischen den Energieniveaus von Reaktanten und Produkten wird als Enthalpieänderung (ΔH) bezeichnet. Bei einer exothermen Reaktion ist das ΔH NEGATIV. Bei einer endothermen Reaktion ist das ΔH POSITIV.,
Wussten Sie schon?
Wissenschaftler können Energie in Lebensmitteln messen, indem sie messen, wie viel Wärme das Lebensmittel beim Verbrennen freisetzt. Sie messen dies mit einem Werkzeug namens Bombenkalorimeter.
Es ist möglich ΔH zu berechnen, ohne ein Experiment durchzuführen! Wissenschaftler haben experimentell die Energien bestimmt, die erforderlich sind, um spezifische molekulare Bindungen herzustellen und zu brechen. Diese Energien werden als durchschnittliche Bindungsenergien bezeichnet.,r>
Mit dem Methanverbrennungsbeispiel funktioniert die Mathematik erneut wie folgt:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
Da die Enthalpieänderung negativ ist, wissen wir, dass die Reaktion exotherm sein wird.,
Wie funktioniert Thermodynamik in einer Kühlpackung?
Nun gehen wir zurück zu unserem Instant Cold Pack. Eine sofortige Kaltpackung ist das perfekte Beispiel für eine endotherme Reaktion. Es gibt viele mögliche Zutaten in einer sofortigen Kaltpackung, aber sie enthalten oft festes Ammoniumnitrat und Wasser.
Wussten Sie schon?,
Ammoniumnitrat ist ein Nitratsalz. Es wird stark in der Landwirtschaft als Dünger verwendet. Es wird auch als Sprengstoff in der Bergbauindustrie verwendet.
Das Ammoniumnitrat wird in einer versiegelten Plastiktüte gelagert, die von Wasser umgeben ist. Wenn Sie den Beutel öffnen, kommt das Ammoniumnitrat mit Wasser in Kontakt und löst sich auf.
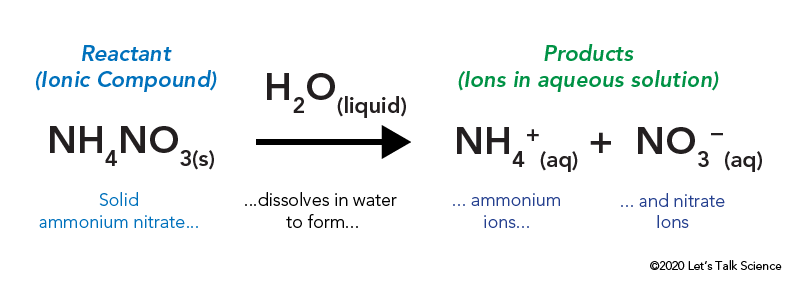
Das Auflösen einer ionischen Verbindung wie Speisesalz oder Ammoniumnitrat erfordert Energie. Wie andere Arten von Reaktionen kann Wärmeenergie abgegeben oder aufgenommen werden, wenn sich das Material auflöst. Diese Energie wird als Energie der Lösung bezeichnet und kann als ΔHsoln geschrieben werden.
ΔHsoln = ∑ΔH – ∑ΔH
Anstatt den ΔH für die Reaktanten und Produkte unter Verwendung von Bindungsenergien zu ermitteln, verwenden Wissenschaftler häufig vorberechnete Werte für Standardenthalpie der Bildung (ΔH°f) Tabellen., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
Berechnen wir die Energie der Lösung
ΔHsoln = Δ ΔH – ∑ΔH
= –
= –
= – 339,4 + 365,1
= 25,7 kJ
Denken Sie am Anfang daran, dass, wenn ΔH NEGATIV ist, die Reaktion exotherm ist und dass, wenn ΔH POSITIV ist, die Reaktion endotherm ist? Nun, das gilt auch für Energie von Lösungsproblemen. Da wir berechnet haben, dass der ΔHsoln positiv war (25,7 kJ), muss die Reaktion endotherm sein. Wir wissen, dass dies wahr ist, weil das Cold Pack seine Umgebung sehr kalt gemacht hat!,
Zusammenfassung…
Exotherme und endotherme Reaktionen sind wichtig für unsere chemische Welt. Diese Reaktionen können dazu beitragen, uns warm zu halten, indem sie Energie abgeben (exotherm) oder uns abkühlen, indem sie Energie aufnehmen (endotherm).
