is dit u ooit overkomen? Je loopt in de gymles en je verdraait je enkel. Het doet pijn en begint op te zwellen. Je leraar pakt de verbanddoos en haalt er een instant cold pack uit. Na één goede knijp wordt het pak bijna direct heel koud. Wat gebeurt er? Hoe maken de chemicaliën de verpakking zo snel koud? Het antwoord is te vinden in thermodynamica! Dit is een tak van wetenschap die de overdracht van energie onderzoekt., In de thermodynamica kunnen chemische reacties worden geclassificeerd als endotherm of exotherm.
Wat zijn de twee belangrijkste typen thermodynamische reacties?
exotherme reacties zijn reacties die energie afgeven in de vorm van warmte. U kent waarschijnlijk veel voorbeelden van deze reacties. Bijvoorbeeld, het verbranden van benzine in de motor van een auto is een exotherme reactie. Deze bijzondere vorm van exotherme reactie staat bekend als een verbrandingsreactie., Een verbrandingsreactie treedt op wanneer een verbinding, zoals de koolwaterstoffen waaruit brandstof bestaat, reageert met zuurstof om een nieuw product te vormen en warmte te produceren.
endotherme reacties zijn het tegenovergestelde van exotherme reacties. Ze absorberen warmte-energie uit hun omgeving. Dit betekent dat de omgeving van endotherme reacties kouder is als gevolg van de reactie. Smeltend ijs is een voorbeeld van dit type reactie.
Hoe weet u welk type thermodynamische reactie er plaatsvindt?
een manier om dit te doen is door te kijken naar het systeem en de omgeving van een reactie., Het systeem is waar de reactie plaatsvindt, en de omgeving is het gebied rond het systeem.
om te bepalen of een reactie exotherm of endotherm is, kunt u:
- de temperatuurverandering van het systeem of zijn omgeving meten, of
- de energie van het systeem berekenen.
van deze twee methoden is het meten van de temperatuurverandering gemakkelijker. Om dit te doen, meet je gewoon de temperatuur van een reactie voor en nadat deze is voltooid., Omdat het soms moeilijk kan zijn om de temperatuur binnen het systeem van een reactie te meten, meten wetenschappers vaak de temperatuur van de omgeving in plaats daarvan.
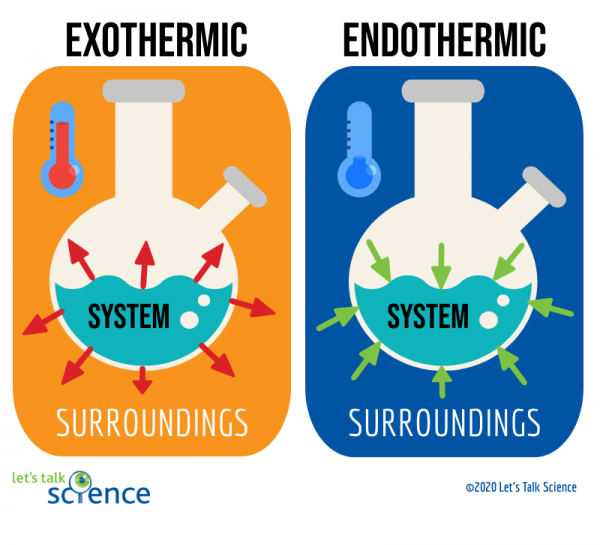
Het is mogelijk om te voorspellen of een reactie endotherm of exotherm zal zijn door een beetje wiskunde. Hiervoor helpt het om een beetje te weten over chemische reacties en chemische bindingen.,
Er zijn twee kanten aan elke chemische reactie. Aan de ene kant zijn de reagentia. Een reagens is de stof (of stoffen) waarmee je begint. Aan de andere kant zijn de producten. Een product is de stof, of stoffen, die je uiteindelijk met Nadat de reactie gebeurt.
bij een chemische reactie worden de chemische bindingen in de reactantmoleculen verbroken. Nieuwe bindingen worden gevormd in de productmoleculen. Een voorbeeld is de verbrandingsreactie tussen methaan (CH4) zuurstof (O2) (de reagentia) die kooldioxide (CO2) en water (H20) moleculen (de producten) produceert., Bindingen worden verbroken in de methaan-en zuurstofmoleculen. Bindingen worden gevormd in de koolstofdioxide-en watermoleculen.
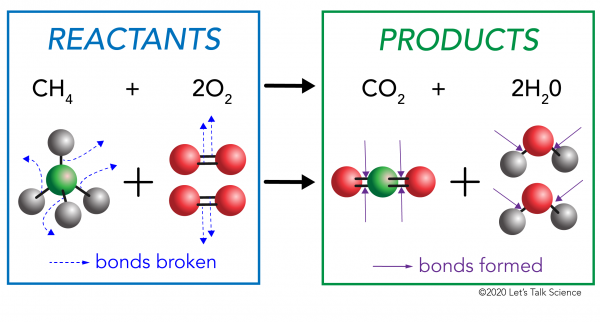
wat belangrijk is om te weten is dat er energie nodig is om zowel bindingen te maken als te breken., Om te bepalen of een reactie exotherm of endotherm is, moet je de hoeveelheid energie die nodig is om de bindingen van de reagentia te breken vergelijken met de hoeveelheid energie die vrijkomt wanneer nieuwe bindingen worden gemaakt. Als de hoeveelheid energie die vrijkomt bij de vorming van de nieuwe bindingen in de producten groter is, dan is het een exotherme reactie. Als de hoeveelheid energie die nodig is om de bindingen van de reagentia te breken groter is, dan is het een endotherme reactie.
een manier om dit te laten zien is met behulp van een energiediagram. Energiediagrammen tonen de energieniveaus van reagentia en producten in een reactie.,
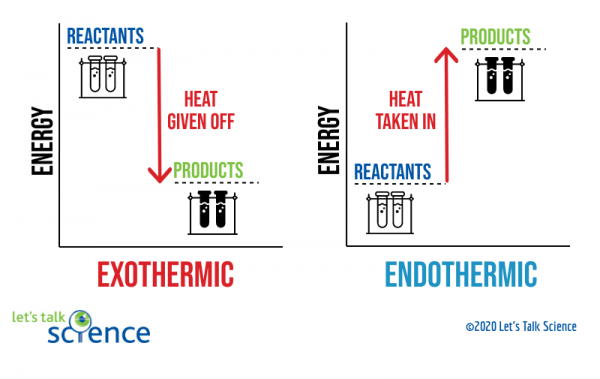
uit het bovenstaande diagram kunt u zien dat het energieniveau van de producten van een exotherme reactie lager is dan het energieniveau van de reagentia. Het verschil tussen de energieniveaus van reagentia en producten wordt de enthalpieverandering (ΔH) genoemd. In een exotherme reactie is de ΔH negatief. In een endotherme reactie is de ΔH positief.,
wist u dat?
wetenschappers kunnen de energie in levensmiddelen meten door te meten hoeveel warmte het voedsel vrijmaakt wanneer het wordt verbrand. Ze meten dit met behulp van een tool genaamd een bomcalorimeter.
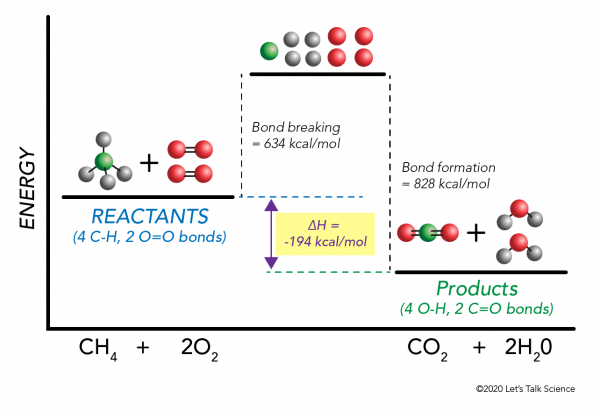
Het is mogelijk ΔH te berekenen zonder zelfs maar een experiment uit te voeren! Wetenschappers hebben experimenteel de energieën bepaald die nodig zijn om specifieke moleculaire bindingen te maken en te breken. Deze energieën staan bekend als gemiddelde bindingsenergieën.,r>
met Behulp van de methaan verbranding weer het voorbeeld van de wiskunde werkt als volgt:
ΔH = –
= –
= –
= –
= 634 – 828
= – 194 kcal/mol
Sinds de enthalpie verandering is negatief, we weten dat de reactie zal worden exotherme.,
Hoe werkt thermodynamica in een koude verpakking?
nu gaan we terug naar onze instant cold pack. Een instant cold pack is het perfecte voorbeeld van een endotherme reactie. Er zijn veel mogelijke ingrediënten in een instant cold pack, maar ze bevatten vaak vast ammoniumnitraat en water.
wist u dat?,
ammoniumnitraat is een nitraatzout. Het wordt veel gebruikt in de landbouw als meststof. Het wordt ook gebruikt als explosief in de mijnbouw.
het ammoniumnitraat wordt opgeslagen in een gesloten plastic zak die omgeven is door water. Wanneer u de zak opent, komt het ammoniumnitraat in contact met water en lost het op.
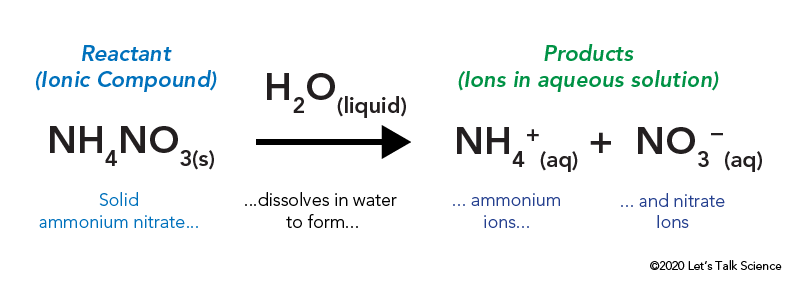
het oplossen van een ionische verbinding, zoals keukenzout of ammoniumnitraat, vereist energie. Net als andere soorten reacties, kan warmte-energie worden afgegeven of opgenomen wanneer het materiaal oplost. Deze energie wordt de energie van oplossing genoemd en kan worden geschreven als ΔHsoln.
ΔHsoln =δ ΔH-δ ΔH
in plaats van de ΔH uit te werken voor de reactanten en producten met behulp van bindingsenergieën, gebruiken wetenschappers vaak vooraf berekende waarden op standaard-enthalpie van vorming (ΔH°f) tabellen., From such a table we learn that:
| ΔH°f | kJ/mol |
|---|---|
| NH4+(aq) | -132.8 |
| NH4NO3(s) | -365.1 |
| NO3-(aq) | -206.,6 |
reken uit om de energie van oplossing
ΔHsoln = δ ΔH – δ ΔH
= –
= – 339.4 + 365.1
= 25.7 kj
Weet je nog dat we aan het begin zeiden dat als ΔH negatief is, de reactie exotherm is en dat als ΔH positief is, de reactie endotherm is? Nou, dat geldt ook voor energie van oplossing problemen. Aangezien we berekenden dat de ΔHsoln positief was (25,7 kJ), moet de reactie endotherm zijn. We weten dat dit waar is omdat de cold pack zijn omgeving erg koud heeft gemaakt!,
samenvattend…
exotherme en endotherme reacties zijn belangrijk voor onze chemische wereld. Deze reacties kunnen helpen om ons warm te houden door energie af te geven (exotherm) of om ons af te koelen door energie op te nemen (endotherm).
